170955 0
يمكن أن تحتوي ذرة الجلد على عدد حقيقي من الإلكترونات.
عند الدخول في تفاعلات كيميائية ، تطلق الذرات إلكترونات أو تنتفخ أو تستعمل الإلكترونات ، لتصل إلى التكوين الإلكتروني الأكثر استقرارًا. الأكثر استقرارًا هو التكوين الذي يحتوي على أقل طاقة (كما هو الحال في ذرات الغازات الخاملة). هذا الانتظام يسمى "قاعدة الثمانيات" (الشكل 1).
مال. 1.
حكم تسي zastosovuetsya للجميع أنواع المكالمات. تسمح الروابط الإلكترونية بين الذرات لها بتكوين هياكل مستقرة ، من أبسط البلورات إلى الجزيئات الحيوية القابلة للطي ، والتي ، في الغلاف النهائي ، هي أنظمة حية. تتسرب الرائحة الكريهة عبر البلورات مع تبادل غير منقطع للكلمات. عندما تستمر العديد من التفاعلات الكيميائية من خلال الآليات التحويل الإلكترونيحيث أنها تلعب أهم دور في عمليات الطاقة في الجسم.
الرابط الكيميائي هو القوة الكاملة التي يمكن التغلب عليها في نفس الوقت ذرتين أو أكثر أو أيونات أو جزيئات أو مزيجًا.
طبيعة الرابطة الكيميائية عالمية: القوة الكهروستاتيكية للجاذبية بين الإلكترونات سالبة الشحنة والنواة موجبة الشحنة ، والتي تعتمد على تكوين الغلاف الخارجي للإلكترون للذرات. يسمى تكوين الذرة لإنشاء روابط كيميائية تكافؤ، أو مرحلة الأكسدة. التكافؤ Z مرتبط بفهم إلكترونات التكافؤ- الإلكترونات ، التي تصنع روابط كيميائية ، بحيث تتواجد في أكثر المدارات عالية الطاقة. على ما يبدو ، يسمى اسم قذيفة الذرة ، وهو الانتقام من المدارات التكافؤ مدار. في هذا الوقت ، لا يكفي الإشارة إلى وجود رابطة كيميائية ، ولكن من الضروري تحديد النوع: أيوني ، تساهمي ، ثنائي القطب ، معدن.
النوع الأول من الارتباط هوأيونا يتصل
وفقًا لنظرية التكافؤ الإلكترونية التي وضعها لويس وكوسيل ، يمكن للذرات الوصول إلى تكوين إلكتروني مستقر بطريقتين: أولاً ، عن طريق استهلاك الإلكترونات ، عن طريق التحول إلى الايونات الموجبة، بطريقة مختلفة ، الاستحمام بهم ، والتحول إلى الأنيوني. نتيجة للتحويل الإلكتروني لقوة الجاذبية الكهروستاتيكية بين الأيونات بشحنات الإشارة المعاكسة ، يتم إنشاء رابطة كيميائية ، سميت من قبل Kossel " كهربية(الآن її اتصل أيوني).
بهذه الطريقة ، تنشئ الأنيونات والكاتيونات مجموعة من التكوين الإلكتروني من غلاف إلكتروني خارجي ثابت. تتكون الروابط الأيونية النموذجية من كاتيونات مجموعات T و II من النظام الدوري وأنيونات العناصر غير المعدنية للمجموعات السادسة والسابعة (16 و 17 مجموعة - vіdpovidno ، الكالكوجيناتі الهالوجينات). الروابط في الأيونات الأيونية غير موجودة وغير اتجاهية ، لذلك يتم حفظ إمكانية التفاعل الكهروستاتيكي مع الأيونات الأخرى منها. على التين. يُظهر الشكلان 2 و 3 أمثلة على الروابط الأيونية ، على غرار نموذج كوسيل لنقل الإلكترون.
مال. 2.
مال. 3.روابط أيونية في جزيء ملح المطبخ (NaCl)
من الجيد هنا التحدث عن شمامسة السلطة ، لشرح سلوك الخطب في الطبيعة ، زوكريما ، انظر إلى الحقائق حول الأحماضі بودستافاخ.
توزيع الماء لكل هذه الخطابات مع الإلكتروليتات. الرائحة الكريهة تتغير بطريقة مختلفة zabarvlennya المؤشرات. آلية dіїndikatorіv buv vіdkritiy F.V. اوستوالد. أظهر Vіn أن المؤشرات عبارة عن أحماض أو بدائل ضعيفة ، والتي يمكن العثور عليها في البلدان غير المنفصلة وغير المنفصلة.
أرسل معادلات الحمض. لا يمثل كل منهم الاختلافات في الماء (على سبيل المثال ، الأفعال غير التمييزية للنصف العضوي ، لذلك لا تفوت - مجموعة OH ، zokrema ، ثلاثي إيثيل أمين N (C 2 H 5) 3)؛ اسم المراعي.
تدخل الأحماض المائية في تفاعلات مميزة:
أ) مع أكاسيد المعادن - مع محاليل الملح والماء ؛
ب) بالمعادن - بالملح والماء ؛
ج) بالكربونات - مع الأملاح الذائبة ، كو 2 ط ح 2 ا.
تصف هيمنة الأحماض والمحطات الفرعية بعض النظريات. الدليل على نظرية S.A. أرهينيوس ، الحمض كلام ، تفكك من الأيونات ح+ ، فقط كدعم ، أصنعها فين-. نظرية Tsya ليست آمنة على أساس المحطات الفرعية العضوية ، لأنها لا تسمح بمجموعات الهيدروكسيل.
صالح حتى بروتونوفقًا لنظرية برونستيد ولوري ، فإن الحمض هو الكلام ، والذي يمكنه الانتقام من الجزيئات أو الأيونات التي تعطي البروتونات ( المتبرعينالبروتونيف) ، والقاعدة هي الكلام ، والتي تتكون من جزيئات أو أيونات ، مثل أخذ البروتونات ( يقبلونبروتونيف). من المهم أنه في مصادر المياه يستخدمون الماء في شكل رطب ، لذلك تبدو مثل الأيونات في الهيدروكسونيوم H3O+. تصف هذه النظرية التفاعلات ليس فقط مع أيونات الماء والهيدروكسيد ، ولكنها تعتمد أيضًا على طبيعة بائع التجزئة أو بائع التجزئة غير المائي.
على سبيل المثال ، في التفاعل مع الأمونيا نيو هامبشاير 3 (قاعدة ضعيفة) وكلوريد الهيدروجين في الطور الغازي يذوب كلوريد الأمونيوم الصلب ، علاوة على ذلك ، في مجموع نفس الأهمية من خطابين ، يوجد 4 أجزاء ، اثنان منهم - أحماض ، واثنان آخران - القواعد:
هذا المجموع مهم بنفس القدر ، فهو يتكون من مجموعتين من أزواج الأحماض وبدائلها:
1)نيو هامبشاير 4 + ط نيو هامبشاير 3
2) حمض الهيدروكلوريكі Cl ‑
هنا ، في الاقتران الجلدي ، يتم فصل الحمض والركيزة بواسطة بروتون واحد. يمكن استخدام حمض الجلد معها. والحمض القوي أقوى من الضعيف ، والحمض الضعيف أقوى من الأحماض السفلية.
تسمح نظرية برونستيد-لوري بشرح الطابع الفريد لدور الماء في حياة المحيط الحيوي. يمكن أن يُظهر الماء ، في البور في خطاب vіd vzaєmodіє z ، هيمنة أو حمض ، أو podstava. على سبيل المثال ، في التفاعلات مع الأنواع المائية من حمض الأكسوجيك ، يكون الماء بديلاً ، ومع الأنواع المائية من الأمونيا ، حمض.
1) CH3COOH + H 2 O ↔ H 3 O + + CH 3 سو-. هنا يتبرع جزيء حمض الأوكتيك ببروتون لجزيء الماء ؛
2) NH3 + H 2 O ↔ NH4 + + فين-. هنا جزيء الأمونيا يقبل بروتونًا من جزيء الماء.
بهذه الطريقة ، يمكن للمياه أن تحقق رهانين ناجحين:
1) H 2 O(حمض) ط فين- (خاضع للتقديم)
2) H 3 O+ (حمض) ط H 2 O(سأنتظر لاحقًا).
في الوضع الأول ، يتبرع الماء بالبروتون ، وفي الوضع الآخر ، يقبل اليوجا.
هذه القوة تسمى amphiprotonity. الكلام ، zdatnі يدخل في ردود فعل مثل الأحماض ، وتسمى subav مذبذب. في الطبيعة الحية ، غالبًا ما تُسمع مثل هذه الخطب. على سبيل المثال ، يمكن خلط الأحماض الأمينية مع الأملاح والأحماض والبدائل. لذلك ، يمكن بسهولة تنسيق الببتيدات مع وجود أيونات معدنية.
في مثل هذه المرتبة ، تكون قوة الرابطة الأيونية مميزة - من الممكن التحرك حول الإلكترونات إلى إحدى النوى. يعني Tse أن هناك منطقة بين الأيونات ، وأن المجال الإلكتروني قد يكون صفراً.
نوع آخر من المكالمات هوتساهمية يتصل
يمكن للذرات أن تصنع تكوينات إلكترونية مستقرة عن طريق قابلية استخدام الإلكترونات.
يتم إنشاء مثل هذا الاتصال إذا كان يمكن استخدام زوج من الإلكترونات واحدًا تلو الآخر نوع الجلدذرة. بهذه الطريقة ، يكون الإلكترون مفيدًا ، وتنقسم الرابطة بين الذرات بالتساوي. يمكن استدعاء مؤخرات الرابطة التساهمية متجانس النوىثنائي الذرة جزيئات H. 2 , ن 2 , F 2. نفس النوع من السندات في alotropy ا 2 ط الأوزون ا 3 أنا في جزيء ذري غني س 8 ، وكذلك جزيئات غير متجانسةماء الكلور هكل، ثاني أكسيد الكربون كو 2 ، الميثان CH 4 ، الإيثانول دبليو 2 ح 5 فين، سيركا سداسي فلوريد سادس 6 ، الأسيتيلين دبليو 2 ح 2. ولكن في جميع جزيئات الإلكترونات ، يكون الارتباط متشابهًا ، وتتشابه روابطها في الحجم والاستقامة (الشكل 4).
بالنسبة لعلماء الأحياء ، من المهم أن يكون أنصاف الأقطار التساهمية للذرات في الروابط السفلية والسفلية لها نصف قطر ذري تساهمي مع تغيير الرابطة الواحدة.
مال. 4.الرابطة التساهمية في جزيء Cl 2.
أنواع الروابط الأيونية والتساهمية - هناك نوعان حدوديان من أنواع الروابط الكيميائية المجهولة والواضحة ، علاوة على ذلك ، من الناحية العملية ، هناك المزيد من الروابط في الصناعة.
Z'dnannya عنصرين ، raztashovannyh في protelazhnyh kіtsyah واحدة أو فترات أخرى من نظام Mendeliev ، من المهم إنشاء ionnі zv'yazku. في عالم تقارب العناصر في الفترة الفاصلة ، يتغير الطابع الأيوني لعناصرها ، ويزداد الطابع التساهمي. على سبيل المثال ، تؤسس النترات وأكاسيد العناصر الموجودة في الجزء الأيسر من الجدول الدوري رابطة أيونية مهمة ( كلوريد الصوديوم ، AgBr ، BaSO 4 ، CaCO 3 ، KNO 3 ، CaO ، هيدروكسيد الصوديوم) ، وكذلك العناصر الموجودة في الجزء الأيمن من الجدول تساهمية ( H 2 O، CO2، NH 3، NO 2، CH 4الفينول C6H5OHالجلوكوز Z 6 H 12 O 6، الإيثانول Z 2 H 5 OH).
الرابطة التساهمية ، في خطها ، لها تعديل واحد فقط.
في الأيونات الذرية الغنية والجزيئات البيولوجية القابلة للطي ، يمكن فقط امتصاص عدد قليل من الإلكترونات واحدذرة. يسمى فين جهات مانحةالمراهنات الإلكترونية. تسمى الذرة التي يمكن استخدامها مع زوج متبرع من الإلكترونات متقبلالمراهنات الإلكترونية. يسمى هذا النوع من الرابطة التساهمية التنسيق (المتبرع المتقبل), أوdative) صوتي(الشكل 5). هذا النوع من الترابط هو الأهم بالنسبة لعلم الأحياء والطب ، وأهم الكيميائيات لعملية التمثيل الغذائي لعناصر د في العالم المهم موصوفة بروابط التنسيق.
صورة. 5.
كقاعدة عامة ، في التبادل المعقد ، تعمل ذرة المعدن كمقبول للرهان على الإلكترون ؛ Navpaki ، مع الروابط الأيونية والتساهمية ، فإن ذرة المعدن هي متبرع بالإلكترون.
يمكن توضيح جوهر الارتباط التساهمي و її raznovidi - ارتباط التنسيق - بمساعدة نظرية أخرى للأحماض والمحطات الفرعية ، GN الدعائية. لويس. وسع فين ديششو معنى المصطلحين "حمض" و "قاعدة" لنظرية برونستيد-لوري. تشرح نظرية لويس طبيعة دمج الأيونات المعقدة ودور الكلام في تفاعلات الاستبدال النووي ، وبالتالي في دراسة CS.
وفقًا لـ Lewis ، الحمض عبارة عن cerechovina ، فمن الممكن إنشاء رابطة تساهمية مع طريقة قبول رهان إلكتروني في شكل ردم. يُطلق على بديل لويس اسم الكلام ، والذي لا يندمج مع زوج إلكترون ، والذي ، من خلال التبرع بالإلكترونات ، يصنع رابطة تساهمية مع حمض لويس.
هذا هو السبب في أن نظرية لويس تتوسع في عدد التفاعلات الحمضية القاعدية والتفاعلات التي لا تأخذ فيها البروتونات المصير نفسه. علاوة على ذلك ، فإن البروتون نفسه ، وفقًا للنظرية ، هو أيضًا حمض ، شظايا المبنى تقبل زوجًا من الإلكترونات.
أيضًا ، وفقًا للنظرية ، الكاتيونات هي أحماض لويس ، والأنيونات هي بدائل لويس. يمكن استخدام ردود الفعل التالية كمثال:
الأهم من ذلك أن الخطاب قد تم تشكيله على الركائز الأيونية والتساهمية ، ولكن لا توجد آثار لانتقال كامل للإلكترون من الذرات في المعدن إلى الذرات المستقبلة في الجزيئات التساهمية. في المركبات ذات الجلد اللزج الأيوني ، يكون الأيون في المجال الكهربائي لأيونات الإشارة المعاكسة ، وبالتالي فإن الرائحة الكريهة مستقطبة بشكل متبادل ، وتشوه أصدافها.
الاستقطابيعتمد على الهيكل الإلكتروني والشحنة وأبعاد الأيون ؛ في الأنيونات هو أعلى وأقل في الكاتيونات. أكبر استقطاب للكاتيونات الوسطى يكون في الكاتيونات ذات الشحنة الأكبر والحجم الأصغر ، على سبيل المثال ، في Hg 2+، Cd 2+، Pb 2+، Al 3+، Tl 3+. قد يكون تأثير الاستقطاب القوي ح+. ستؤدي الشظايا ، التي تتدفق في استقطاب الأيونات بطريقة ثنائية ، إلى تغيير كبير في قوة القوى التي أنشأتها.
النوع الثالث من الارتباط هوثنائي القطب ثنائي القطب يتصل
أنواع pereakhovanyh كريم vyazka ، rozryznyayut shche ثنائي القطب ثنائي القطب بين الجزيئات vzaєmodії ، الرتب أيضًا خاص van der Waal .
تكمن قوة هذه التفاعلات في طبيعة الجزيئات.
يظهر في vzaєmodії ثلاثة أنواع: ثنائي القطب الدائم - ثنائي القطب الدائم ( ثنائي القطب ثنائي القطبجاذبية)؛ ثنائي القطب post_yny - ثنائي القطب التعريفي ( تعريفيجاذبية)؛ ميتييفي ثنائي القطب - ثنائي القطب التعريفي ( تشتتالوزن ، أبو قوى لندن ؛ مال. 6).
مال. 6.
فقط الجزيئات ذات الروابط التساهمية القطبية ( حمض الهيدروكلوريك ، NH 3 ، SO 2 ، H 2 O ، C 6 H 5 Cl) ، علاوة على ذلك ، تصبح قوة الارتباط 1-2 ديباي(1D = 3.338 × 10-30 كولوم متر - C × م).
في الكيمياء الحيوية ، يُرى نوع آخر من الاتصال - فودنيفو zv'azok ، scho ثنائي القطب ثنائي القطبجاذبية. يتم إنشاء هذا الرابط من خلال روابط ثقيلة بين ذرة الماء والذرة الكهربية ذات الحجم الصغير ، والأهم من ذلك كله - الحامض والفلور والنيتروجين. مع الذرات الكبيرة ، التي لها تأثير كهرسلبي مماثل (على سبيل المثال ، مع الكلور والكبريت) ، يكون الارتباط المائي أضعف بشكل ملحوظ. تستيقظ ماء الذرة من خلال ميزة أساسية واحدة: عندما يتم استدعاء الإلكترونات ، تنكشف النواة - البروتون - وتتوقف الإلكترونات عن حجبها.
لذلك ، تتحول الذرة إلى ثنائي القطب كبير.
تم إنشاء الارتباط المائي ، على vіdmіnu vіd van der Waals ، ليس فقط من خلال التفاعلات بين الجزيئات ، ولكن أيضًا في منتصف جزيء واحد - ضمجزيئي عامل ضمن الجزيئ vodneva zv'yazok. تلعب الروابط المائية دورًا مهمًا في الكيمياء الحيوية ، على سبيل المثال ، لتثبيت بنية البروتينات في شكل حلزون ، أو لإنشاء حلزون DNA متغير (الشكل 7).
الشكل 7.
رابط Vodneva و van der Waals أضعف بشكل ملحوظ وأقل أيوني وتساهمي وتنسيق. يتم عرض طاقة الروابط بين الجزيئات في الجدول. 1.
الجدول 1طاقة القوى الجزيئية
ملحوظة: تتميز خطوات التفاعلات بين الجزيئات بمؤشرات المحتوى الحراري للذوبان والتبخر (الغليان). بالنسبة للأيونات السفلية ، هناك حاجة إلى مزيد من الطاقة للأيونات السفلية ، وطاقة أقل للجزيئات السفلية. المحتوى الحراري لذوبان المركبات الأيونية أعلى بكثير من الطبقات الجزيئية.
النوع الرابع من الارتباط هوzv'yazok المعدنية
ناريشتي ، هناك نوع آخر من الروابط بين الجزيئات - ميتالفيوم: روابط الأيونات الموجبة للشبكة المعدنية بالإلكترونات الحرة. في الكائنات البيولوجية ، لا يتم تثبيت هذا النوع من الاتصال.
من نظرة قصيرة على أنواع الروابط ، يتم الكشف عن تفاصيل واحدة: معلمة مهمة للذرة أو أيون معدني - مانح للإلكترون ، وأيضًا ذرة - متقبل إلكترون - يوغا روزمير.
بدون الخوض في التفاصيل ، من المهم أن نصف القطر التساهمي للذرات ، ونصف القطر الأيوني للمعادن ، وأنصاف أقطار فان دير فال للجزيئات المتفاعلة تزداد في عالم الأرقام التسلسلية المتزايدة في مجموعات من النظام الدوري. بأية قيمة من نصف القطر الأيوني - الأصغر ، ونصف قطر فان دير فال - الأكبر. كقاعدة عامة ، مع انخفاض روسيا في المجموعة ، يزداد أنصاف أقطار جميع العناصر ، علاوة على ذلك ، فهي تساهمية وفان دير فال.
ربما الأكثر أهمية لعلم الأحياء والطب تنسيق(متقبل المانح) Zv'yazku ، كيمياء التنسيق scho razglyadyutsya.
عضوي حيوي طبي. ك. غنم
.
يمكنك أن ترى أن الذرات يمكن أن تنضم إلى واحدة بأخرى بكلتا الخطابات البسيطة والمطوية. يتم إنشاء أنواع مختلفة من الروابط الكيميائية: أيوني وتساهمي (غير قطبي وقطبي) ومعدني ومائي.واحدة من أعظم قوى ذرات العناصر ، والتي تدل على نوع الرابطة التي تنشأ بينها - أيونا أو تساهمية ، - التجارة الإلكترونية ، بحيث أن بناء الذرات في العالم يجذب الإلكترونيات لنفسه.
يعطي مقياس السلبية الكهربائية الإيجابية مقياسًا جديدًا لتقييم الكهربية.
في الفترات ، هناك اتجاه عام لزيادة المقاومة الكهربائية للعناصر ، وفي المجموعات - سقوطها. يتم وضع العناصر بشكل سلبي كهربائيًا في صف واحد ، يمكن على أساسه مقارنة السلبية الكهربية للعناصر الموجودة في فترات مختلفة.
يجب إيداع نوع الرابطة الكيميائية في ضوء حقيقة أن الفرق في قيمة الكهربية بين ذرات العناصر كبير. كلما زادت كهرسلبية ذرات العناصر التي تشكل الروابط ، زادت الروابط الكيميائية القطبية. لا يمكن التمييز بين أنواع الروابط الكيميائية. في معظم الحالات ، يبدو أن نوع الرابطة الكيميائية وسيط ؛ على سبيل المثال ، الرابطة الكيميائية التساهمية عالية القطبية قريبة من الرابطة الأيونية. من المهم ملاحظة أنه ، إلى أي مدى تكون الروابط الكيميائية أقرب إلى الحدود بسبب طبيعتها ، يمكن إحضارها إما إلى الأيونية أو إلى الرابطة القطبية التساهمية.
سوف اتصل.يتم إنشاء الروابط من خلال تفاعل الذرات ، كما لو أن نوعًا واحدًا يتميز بحدة بواسطة الكهربية.على سبيل المثال ، تشكل المعادن النموذجية مثل الليثيوم (Li) ، والصوديوم (Na) ، والبوتاسيوم (K) ، والكالسيوم (Ca) ، والسترونشيوم (Sr) ، والباريوم (Ba) رابطة أيونية مع غير المعادن النموذجية ، خاصة مع الهالوجينات.
كريم من هاليدات البركة المعدنية ، يتم تسوية الرابطة الأيونية أيضًا في مثل هذه الظروف ، مثل المروج والملح. على سبيل المثال ، في هيدروكسيد الصوديوم (NaOH) وكبريتات الصوديوم (Na 2 SO 4) ، تكون الروابط الأيونية فقط بين ذرات الصوديوم والحمض (الروابط التساهمية هي استقطاب تساهمية).
الارتباط التساهمي غير القطبي.عندما تتفاعل الذرات مع نفس السلبية الكهربائية ، تذوب الجزيئات ذات الرابطة التساهمية غير القطبية. Takii Zv'yazov Isnuu في جزيئات جرائم Rechovin: h 2 ، f 2 ، cl 2 ، o 2 ، n 2. XIMICHNISHISK في QIX GAZS DRIEND للبخار Elektron المسبق ، Tobto عند إعادة تصميمه بواسطة gmar ، إلكترون على شكل تكبير- vzaimodiy-naslіdkom نووي ، yakі zdіysnyuє عندما تكون الذرات قريبة.
بتجميع الصيغ الإلكترونية للخطابات ، متبوعة بالذاكرة ، أن زوج الإلكترون المعزز بالجلد هو الصورة الذهنية للفجوة الإلكترونية المتزايدة ، والتي تنتج عن تشويه الفوضى الإلكترونية.
الرابطة القطبية التساهمية.مع تفاعل الذرات ، تختلف قيم السلبيات الكهربية لهذه الذرات ، ولكن ليس بشكل حاد ، هناك إزاحة لمراهنة الإلكترون الرئيسية إلى ذرة إلكترون سالبة أكبر.أكبر الامتدادات هي نوع الرابطة الكيميائية ، التي تنمو في كل من الطبقات غير العضوية والعضوية.
قبل الروابط غير التساهمية في العالم ، هناك أيضًا روابط تم إنشاؤها بواسطة آلية متلقي المانح ، على سبيل المثال ، في أيونات الهيدروكسونيوم والأمونيوم.
صوت ميتاليف.
يُطلق على الصوت ، الذي تم إنشاؤه نتيجة تفاعل الإلكترونات الحرة نسبيًا مع أيونات المعادن ، صوتًا معدنيًا.هذا النوع من الاتصال هو سمة من سمات معادن الكلام البسيطة.
جوهر عملية إلقاء الضوء على الرابطة المعدنية في الهجوم: ذرات المعدن تعطي بسهولة إلكترونات التكافؤ وتتحول إلى أيونات موجبة الشحنة. بينما الإلكترونات الحرة ، التي تمزقت في الذرة ، تتحرك بين طبقات أيونات المعادن. بينهما vinikaє metal zv'yazok ، أي الإلكترون كأيون ثنائي الإسمنت موجب للشبكة البلورية للمعادن.
نداء الماء.
رابطة تنشأ بين الذرات في جزيء واحد وذرة عنصر كهرسلبي بقوة(س ، ن ، ف) جزيء آخر يسمى ارتباط الماء.
يمكنك إلقاء اللوم على الطعام: لماذا يصنع الماء نفسه مثل هذا الارتباط الكيميائي المحدد؟
ويفسر ذلك حقيقة أن نصف القطر الذري أكبر من صغير. بالإضافة إلى ذلك ، في حالة الإزاحة أو استبدال الإلكترون الفردي ، تمتلئ المياه بشحنة موجبة عالية ، حيث يتفاعل جزيء واحد من الماء مع ذرات العناصر الكهربية ، بحيث يمكن الوصول إلى شحنة سالبة متكررة في مستودع جزيئات أخرى (HF ، H 2 O ، NH 3).
دعونا نلقي نظرة على تطبيق deyakі. يبدو أننا نتخيل المستودع بالصيغة الكيميائية H 2 O. ومع ذلك ، لا نعرف بالضبط. سيكون من الأصح تعيين المستودع بالصيغة (H 2 O) n ، de n \ u003d 2،3،4 وما إلى ذلك.
يُقبل أن يُشار إلى Vodneviy zv'yazok بالنقاط. إنها رابطة أيونية أو تساهمية أضعف نوعًا ما ، ولكنها أقوى وأقل تفاعلًا بين الجزيئات.
يفسر وجود وصلات المياه الزيادة في حجم الماء في درجات الحرارة المنخفضة. ويرجع ذلك إلى حقيقة أنه في درجات الحرارة المنخفضة ، تتغير الجزيئات ويتغير حجم "التعبئة" الخاصة بها.
مع زراعة الكيمياء العضوية ، تم إلقاء اللوم على النظام الغذائي: لماذا تكون درجات حرارة غليان الكحوليات أكثر ثراءً وأقل في الكربوهيدرات؟ يتم تفسير ذلك من خلال حقيقة أنه بين جزيئات الكحول أيضًا يتم إنشاء رابطة مائية.
ترجع الزيادة في درجة حرارة غليان الكحوليات أيضًا إلى تضخم جزيئاتها.
يعتبر الارتباط المائي أيضًا من سمات المركبات العضوية الغنية الأخرى (الفينولات ، والأحماض الكربوكسيلية ، وما إلى ذلك). من خلال الدورة التدريبية في الكيمياء العضوية وعلم الأحياء العالمي ، سترى أن وجود الاتصال المائي يشرح البنية الثانوية للبروتينات ، الحلزون البديل للحمض النووي ، أي مظهر من مظاهر التكامل.
الرابطة الكيميائية التساهمية ، її raznovidi التي mekhanіzmi utvodnya. خصائص الرابطة التساهمية (قطبية وطاقة الرابطة). سوف اتصل. صوت ميتاليف. vodneva zv'yazok
تشكل vchennya حول الارتباط الكيميائي أساس كل الكيمياء النظرية.
تحت رابطة كيميائية ، يمكن للمرء أن يفهم مثل هذا التفاعل بين الذرات ، كما لو أنها تحولها إلى جزيئات ، أيونات ، جذور ، بلورات.
يتم تمييز أنواع مختلفة من الروابط الكيميائية: الأيونية والتساهمية والمعدنية والمائية.
Rozpodіl khіm_chіchnyh zv'yazkіv على teepee ليكون له طابع عقلي ، وفقًا لمدى تميز جميع الروائح الكريهة بوحدة غنائية.
يمكن اعتبار أحد الروابط بمثابة قطرة حدودية للوصلة القطبية التساهمية.
الرابطة المعدنية هي تفاعل تساهمي تدريجي بين الذرات وراء الإلكترونات الاجتماعية الإضافية والجاذبية الكهروستاتيكية بين الإلكترونات وأيونات المعادن.
في الخطب ، غالبًا ما تكون هناك تعبيرات حدودية لاتصال كيميائي (أو ارتباط كيميائي خالص).
على سبيل المثال ، يتم إعطاء فلوريد الليثيوم $ LiF $ للطلبات الأيونية. في الواقع ، في السند الجديد ، 80٪ أيوني و 20٪ تساهمية. من الواضح أنه سيكون من الأصح التحدث عن درجة قطبية (أيونية) الرابطة الكيميائية.
في سلسلة هاليدات الهيدروجين $ HF-HCl-HBr-HI-HA عند $ تتغير درجة قطبية الرابطة ، لكن الاختلاف في قيم الكهربية للذرات في تغيرات الهالوجين والماء ، وفي يوم الأستاتين يصبح السند أقل قطبيًا $ (EO (H) = 2.1 ؛ EO (At) = 2.2) $.
يمكن إصدار أنواع مختلفة من الأصوات في نفس الخطب ، على سبيل المثال:
- في القواعد: بين ذرات الحامض والماء في مجموعات الهيدروكسو ، تكون الروابط تساهمية قطبية ، وبين مجموعات المعادن وهيدروكسو - أيوني ؛
- في أملاح الأحماض الحمضية: بين ذرة غير فلزية وفائض حمضي - قطبي تساهمي ، وبين فائض معدني وحمضي - أيوني ؛
- في أملاح الأمونيوم ، ميثيل الأمونيوم ، إلخ: بين ذرات النيتروجين والماء - قطبي تساهمي ، وبين أيونات الأمونيوم وميثيل الأمونيوم وفائض الحمض - أيوني ؛
- في بيروكسيد المعدن (على سبيل المثال ، Na_2O_2 $) الرابطة بين ذرات الحمض تكون تساهمية غير قطبية ، وبين المعدن والحمض أيوني ، إلخ.
يمكن أن تتداخل أنواع الروابط المختلفة مع بعضها البعض:
- في حالة التفكك الإلكتروليتي في الماء التساهمي ، تتغير الرابطة القطبية التساهمية إلى أيونية ؛
- عندما يتبخر المعدن ، تتحول الرابطة المعدنية إلى رابطة تساهمية غير قطبية ، إلخ.
سبب وحدة جميع أنواع وأنواع الروابط الكيميائية هو نفس طبيعتها الكيميائية - التفاعل بين الإلكترون والنووي. إن إنشاء رابطة كيميائية في أي نوع من الكساد هو نتيجة التفاعل الإلكترون النووي للذرات ، والذي يصاحبه رؤى للطاقة.
طرق حل الرابطة التساهمية. خصائص الرابطة التساهمية: قوة وطاقة الرابطة
الرابطة الكيميائية التساهمية هي رابطة يتم إلقاء اللوم عليها بين الذرات لتكوين أزواج إلكترونية مشتركة.
يمكن تبادل آلية صنع مثل هذا السند والمتبرع المتقبل.
أنا. آلية التبادل dіє ، إذا كانت الذرات تقوم برهان إلكتروني كبير على أموال اتحاد الإلكترونات غير المزاوجة.
1) $ H_2 $ - الماء:
الرابط vinikaє zavdyaki osviti osvіtі e-electronic bet $ s $ -E-Electronic bet $ s $ -E-Electron atoms in water (عكس $ s $ -orbitals):

2) $ HCl $ - ماء الكلور:
تم إلقاء اللوم على الرابط في تسوية رهان إلكتروني مشترك مع إلكترونات $ s- $ i $ p- $ (تجاوز المدارات $ s-p- $):
3) $ Cl_2 $: في جزيء الكلور ، يتم دمج الرابطة التساهمية لقشرة الإلكترونات غير المزاوجة $ p- $ (إعادة تكوين المدارات $ p-p- $):

4) N_2 $: في جزيء النيتروجين بين الذرات ، تم إنشاء ثلاث رهانات إلكترونية عالية النبرة:
ثانيًا. آلية المتبرع المتلقييمكن ملاحظة إنشاء الرابطة التساهمية في تطبيق أيون الأمونيوم $ NH_4 ^ + $.

يمكن للمانح أن يأخذ زوجًا من الإلكترون ، المتقبل - مدارًا مجانيًا ، حتى تتمكن من أخذ هذا الزوج. في أيون الأمونيوم ، كل منهم لديه رابطة تساهمية مع ذرات الماء: تم إنشاء ثلاثة منها لإنشاء أزواج إلكترون مشتركة بواسطة ذرة النيتروجين وذرات الماء بواسطة آلية التبادل ، واحدة - بواسطة آلية المتبرع المتلقي.
يمكن تصنيف الروابط التساهمية وفقًا لطريقة ثني المدارات الإلكترونية ، وكذلك عن طريق تحويلها إلى ذرات رابطة واحدة.
تسمى الروابط الكيميائية ، التي تم إنشاؤها نتيجة لانحناء المدارات الإلكترونية في السندات الخطية ، $ $ -zv'yazkiv (سيغما- zv'yazkami). Sigma-zv'yazok هي أيضًا ميتسنا.

$ P- $ يمكن لف المدارات في منطقتين ، وإنشاء رابطة تساهمية لمربع التواء العضلة ذات الرأسين:

الروابط الكيميائية ، التي يتم تسويتها نتيجة الانحناء "bіchny" للمدارات الإلكترونية بعد وصلة خطية ، أي في منطقتين ، تسمى $ π $ -zv'yazkiv (pі-zv'yazkami).
خلف خطوة الإزاحةيمكن أن تكون أزواج الإلكترونات العالية حتى مستوى واحد مرتبطة بها الذرات في الروابط التساهمية قطبيі الغير قطبي.
تسمى الرابطة الكيميائية التساهمية التي تنشأ بين الذرات التي لها نفس القدرة الكهربية الغير قطبي.لا يتم تحويل التكافؤ الإلكتروني إلى نفس عدد الذرات ، بحيث يمكن للذرات أن يكون لها نفس EO - القدرة على جذب إلكترونات التكافؤ من ذرات أخرى. على سبيل المثال:
لذلك من أجل مساعدة الرابطة التساهمية غير القطبية ، قابلية الذوبان لجزيء بسيط من غير المعادن. رابطة كيميائية تساهمية بين ذرات العناصر ، تسمى كهرسلبية منها قطبي.
Dovzhina وطاقة الرابطة التساهمية.
صفة مميزة هيمنة الرابطة التساهمية- її دوزينة والطاقة. dovzhina zv'yazku- يقف tse بين نوى الذرات. Chemіchna zv'yazok tim mіtsnіshe ، chim less її dovzhina. ومع ذلك ، فإن العالم zv'azku є طاقة المكالمة، يتم تحديد الياك من خلال كمية الطاقة اللازمة لفتح الرابط. صوت خارج كيلوجول / مول. لذلك ، بناءً على البيانات ، إذا كان ارتباط الجزيئات $ H_2 و Cl_2 $ و $ N_2 من المحتمل أن يكون 0.074 دولارًا و 0.198 دولارًا و 0.109 دولارًا نانومترًا ، ويبدو أن طاقة السند تساوي 436 دولارًا ، 242 دولارًا أمريكيًا 946 دولارًا أمريكيًا كيلو جول / مول.
ايوني. آونا zv'azok
يمكننا أن نرى أن ذرتين "مضروبتين": ذرة فلز من المجموعة الأولى وذرة غير معدنية من المجموعة السابعة. تحتوي ذرة المعدن على إلكترون واحد على مستوى طاقتها الخارجية ، والذرة غير المعدنية لا تحتوي حتى على إلكترون واحد ، لذلك يبدو مستوى طاقتها الخارجية مكتملاً.
ترى الذرة الأولى بسهولة وجهة نظر أخرى بعيدة للنواة وتربط إلكترونًا بها بشكل ضعيف ، بينما تمنحك الأخرى إلكترونًا في مساحة خالية على مستواها الإلكتروني الخارجي.
ستصبح إحدى الذرات ، بعد التخلص من إحدى شحناتها السالبة ، جسيمًا موجب الشحنة ، وتتحول الأخرى إلى جسيم سالب الشحنة لضوء الإلكترون الذي تم إقلاعه. تسمى هذه الجسيمات الأيونات.
تسمى الرابطة الكيميائية ، الناتجة عن الأيونات ، الأيونية.
دعنا نلقي نظرة على الرابط بين Cym في مثال علم مشهور لكلوريد الصوديوم (قوة المطبخ):
عملية تحويل الذرات الى صور بالرسم البياني:

وبالتالي ، فإن تحول الذرات إلى أيونات يكون دائمًا هو الحال مع تفاعل ذرات معادن نموذجية وغير فلزية نموذجية.
دعونا نلقي نظرة على خوارزمية (تسلسل) الفحص المجهري عند تسجيل إضاءة الرابطة الأيونية ، على سبيل المثال ، بين ذرات الكالسيوم والكلور:

يتم استدعاء الأرقام التي تظهر عدد الذرات أو الجزيئات معاملات، والأرقام التي تظهر عدد الذرات أو الأيونات في الجزيء تسمى فهارس.
zv'yazok المعدنية
كن على علم بهذا ، كيف تتفاعل ذرات المعادن مع بعضها البعض. لا تبدو المعادن في شكل ذرات معزولة ، ولكن في شكل شماتكا أو ذهب أو فيروبا معدني. ما الذي يجب عمله لتقليل ذرات المعدن في عيار واحد؟
يمكن أن تأخذ ذرات معظم المعادن الموجودة على الجانب الآخر من العالم كمية صغيرة من الإلكترونات - 1 دولار ، 2 ، 3 دولارات. يتم تهوية إلكترونات Qi بسهولة ، وتتحول الذرات إلى أيونات موجبة. تمزقت الإلكترونات ، وانتقلت من أيون إلى آخر ، وربطتها في كل واحد. من خلال الاتصال بالأيونات ، تستقر الإلكترونيات الذرات في نفس الوقت ، ثم يتم إعادة تنشيطها وتعود مع الأيون الآخر ، إلخ. من الآن فصاعدًا ، في رابطة المعدن ، تتحول الذرات بلا انقطاع إلى أيونات ونافباك.
يسمى الارتباط في المعادن بين الأيونات لمساعدة الإلكترونات الاجتماعية بالمعدن.
على الطفل الصغير ، يتم تصوير جزء من معدن الصوديوم بشكل تخطيطي.

إذا كان عدد الإلكترونات الاجتماعية صغيرًا ، فسيكون عدد الأيونات والذرات كبيرًا.

قد يكون للرابطة المعدنية بعض التشابه مع الرابطة التساهمية ، وتعتمد القطع على قابلية استخدام الإلكترونات. ومع ذلك ، في حالة الرابطة التساهمية ، يتم استخدام إلكترونين فقط غير متزاوجين ، بينما في حالة الرابطة المعدنية ، تشارك جميع الذرات في قابلية استخدام هذه الإلكترونات. على نفس المنوال ، البلورات ذات الرابطة التساهمية ، والبلورات المعدنية ، كقاعدة عامة ، بلاستيكية ، موصلة للكهرباء ، ولها بريق معدني.
تعتبر الرابطة المعدنية نموذجية لكل من المعادن النقية ، وكذلك بالنسبة لمجموعات المعادن المختلفة - السبائك ، الموجودة في المصانع الصلبة والنادرة.
vodneva zv'yazok
رابطة كيميائية بين ذرات مستقطبة موجبًا لجزيء واحد (أو أجزاء) وذرات مستقطبة سلبًا لعناصر كهربية قوية ، والتي يمكن أن تولد رهانًا إلكترونيًا غير مستقر ($ F ، O ، N $ وأكثر مثل $ S $ i $ Cl $) ، جزيئات أخرى (أو її أجزاء) تسمى الماء.
غالبًا ما تكون آلية إنشاء رابطة مائية كهروستاتيكية ، وغالبًا ما تكون متقبلًا للمانحين.
ضع مادة رابطة مائية بين الجزيئات:
مع وجود مثل هذا الرابط ، يمكن أن تتشبع الكلمات ذات الوزن الجزيئي المنخفض بمواد طبيعية (كحول ، ماء) أو تتهيج بسهولة بالغازات (الأمونيا ، فلوريد الهيدروجين).
تحدث مع المشابك البلورية الجزيئية اللزجة المائي.
خطاب الحياة الجزيئية وغير الجزيئية. نوع الشبكة البلورية. استقلالية قوة الخطب في مستودعاتهم وحياتهم
الجزيئية وغير الجزيئية
ليست الذرات أو الجزيئات فقط هي التي تدخل في التفاعلات الكيميائية ، بل الكلام. يمكن إعادة تدوير الكلام ، عند إعطائه العقول ، في واحدة من ثلاث حالات مجمعة: صلبة ، أو نادرة ، أو شبيهة بالغاز. تكمن قوة الكلام أيضًا في طبيعة الرابطة الكيميائية بين الجسيمات - الجزيئات أو الذرات أو الأيونات. بالنسبة لنوع الاتصال ، يتم تمييز خطابات الحياة الجزيئية وغير الجزيئية.
الكلمات التي تتكون من الجزيئات تسمى الخطب الجزيئية. الروابط بين الجزيئات في مثل هذه الخطابات أضعف وأضعف بشكل كبير وأقل بين الذرات في منتصف الجزيء ، وحتى في درجات الحرارة المنخفضة المتساوية ترتفع الرائحة النتنة - يتحول الكلام إلى وطن وبعيد إلى غاز (تسامي اليود ). وتتحرك نقطتي الانصهار والغليان ، التي تتكون من جزيئات ، مع زيادة الكتلة الجزيئية.
للخطاب الجزيئي ، يمكن رؤية الكلام بتركيبة ذرية ($ C ، Si ، Li ، Na ، K ، Cu ، Fe ، W $) ، الوسط منها عبارة عن معادن وغير فلزية.
دعونا نلقي نظرة على القوة الفيزيائية لمعادن البركة. zv'yazku vyazku صغير بشكل واضح بين الذرات التكبير الميكانيكي المنخفض: ألقى البرك m'yaki ، وقطع بسهولة بسكين.
تُستخدم الذرات الأكبر حجمًا لإنتاج معادن البرك منخفضة العرض: الليثيوم والصوديوم والبوتاسيوم أسهل للتلف. في مجموعة معادن البركة ، تنخفض درجات حرارة الغليان والذوبان مع زيادة العدد الترتيبي للعنصر ، بحيث تتوسع الذرات ، ويضعف الرابط.
قبل الخطب غير جزيئي budovi vіdnosya іonnі spoluki. مثل هذا الماء الشائع هو أكبر مزيج من المعادن مع اللافلزات: كل الأملاح ($ NaCl ، K_2SO_4 $) ، الهيدريد النشط ($ LiH $) والأكاسيد ($ CaO ، MgO ، FeO $) ، البدائل ($ NaOH ، KOH $). يمكن أن يحتوي الكلام Інні (غير الجزيئي) على نقاط انصهار وغليان عالية.
المشابك الكريستال
الكلام ، كما يبدو ، يمكن استخدامه في ثلاث مصانع مجمعة: شبيهة بالغاز ، ونادرة ، وصلبة.
الكلام الصلب: غير متبلور وبلوري.
دعونا نلقي نظرة على كيفية إضافة خصائص الروابط الكيميائية إلى قوة الخطابات الصلبة. الخطب الصلبة مقسمة إلى كريستالі عديم الشكل.
لا يحتوي الكلام غير المتبلور على درجة حرارة انصهار واضحة - عند تسخينه ، تنعم الرائحة الكريهة تدريجياً وتنتقل إلى حالة سائلة. في حالة غير متبلورة ، على سبيل المثال ، تم العثور على البلاستيسين والراتنجات المختلفة.
تتميز الخطابات البلورية بالانتشار الصحيح للجسيمات الهادئة ، والتي تتكون منها الرائحة الكريهة: الذرات والجزيئات والأيونات - في نقاط محددة بدقة في الفضاء. عندما يتم توصيل هذه النقاط بخطوط مستقيمة ، يتم إنشاء إطار واسع ، عناوين شبكة بلورية. تسمى النقاط التي توضع فيها جزيئات البلورة عقد الشبكة.
وفقًا لنوع الجسيمات ، والتعفن عند عقدة الشبكة البلورية ، وطبيعة الاتصال بينها ، فإنها تميز أنواع chotiri من المشابك البلورية: أيوني ، ذري ، جزيئيі معدن.
المشابك الكريستال الأيونية.
ايونيماستدعاء المشابك البلورية ، في العقد التي توجد فيها أيونات. إنهم يلقون الخطب بصوت أيوني ، والذي يمكن استخدامه ببساطة مثل $ Na ^ (+) ، Cl ^ (-) $ ، لذا مطوي $ SO_4 ^ (2) ، BIN ^ - $. أيضا ، مع الحبيبات البلورية الأيونية ، يتم غسل الأملاح والأكاسيد وهيدروكسيدات المعادن. على سبيل المثال ، يتم طي بلورة من كلوريد الصوديوم إلى أيونات موجبة $ Na ^ + $ وسالب $ Cl ^ - $ ، والتي تشكل شبكة على شكل مكعب. النجوم بين الأيونات في مثل هذه البلورة هي أقواس من الفولاذ. إلى ذلك ، يتم استنشاق الخطابات ذات الشبكات الأيونية بصلابة عالية ومعادن ، والرائحة الكريهة مقاومة للحرارة وغير متطايرة.

المشابك البلورية الذرية.
الذرياستدعاء المشابك البلورية ، في العقد التي توجد فيها ذرات أوكر. في مثل هذه المشابك ، ترتبط الذرات ببعضها البعض بروابط تساهمية أقوى. يمكن أن يكون الماس مثالًا على الخطب مع هذا النوع من المشابك البلورية - أحد الأنواع المتآصلة من الفحم.
قد يكون للخطابات الأكبر حجمًا التي تحتوي على شبكة بلورية ذرية درجة انصهار عالية (على سبيل المثال ، الماس يبلغ 3500 دولارًا. درجة مئوية) ، ورائحة الحجر النتنة والصلبة ، والتي لا يمكن تمييزها عمليًا.

المشابك البلورية الجزيئية.
جزيئياستدعاء المشابك البلورية ، في العقد التي تتناثر الجزيئات. يمكن أن تكون الروابط الكيميائية في هذه الجزيئات إما قطبية ($ HCl ، H_2O $) ، أو غير قطبية ($ N_2 ، O_2 $). بصرف النظر عن تلك التي ترتبط الذرات الموجودة في منتصف الجزيئات بروابط تساهمية قوية ، هناك قوة ضعيفة من الجاذبية بين الجزيئات بين الجزيئات نفسها. لذلك ، قد يكون الحديث مع الحبوب البلورية الجزيئية صلابة منخفضة ، ونقاط انصهار منخفضة ، وطيران. تشكل غالبية المواد العضوية الصلبة شبكات بلورية جزيئية (النفثالين ، الجلوكوز ، الزكور).

المشابك المعدنية الكريستال.
الكلام مع المشابك المعدنية الكريستال المعدنية zv'azky mayut. توجد ذرات وأيونات في عقدة مثل هذه الشبكات (الآن الذرات ، والآن الأيونات ، حيث يتم تحويل الذرات والمعادن بسهولة ، مما يعطي إلكتروناتها الخاصة "في حالة توتر عميق"). يتميز هذا المعدن الداخلي بقوته الفيزيائية المميزة: المرونة ، اللدونة ، التوصيل الكهربائي والحراري ، وهج المعدن المميز.
الرابط الكيميائي هو رابط بين الذرات في جزيء أو رابط جزيئي ، ينتج عن انتقال الإلكترونات من ذرة إلى أخرى ، أو قابلية استخدام الإلكترونات لكلتا الذرتين.
التمييز بين أنواع الروابط الكيميائية dekilka: التساهمية ، الأيونية ، المعدنية ، المائية.
الارتباط التساهمي (اللات. Co - spilno + valens - chinny)
تتبع الرابطة التساهمية بين ذرتين آلية التبادل (تعليق زوج من الإلكترونات) أو آلية متبرع متقبل (إلكترونات مانحة ومدار متقبل حر).
الروابط التساهمية للذرات في جزيئات rechovins البسيطة (Cl 2 ، Br 2 ، O 2) ، rechovins العضوية (C 2 H 2) ، وأيضًا ، في نمط مبعثر ، بين ذرات غير معدنية وأخرى غير المعدنية (NH 3 ، H 2O ، HBr).
إذا كانت الذرات التي تشكل الرابطة التساهمية لها نفس القيمة الكهربية ، فإن الرابطة بينها تسمى الرابطة التساهمية غير القطبية. لا توجد "أقطاب" في مثل هذه الجزيئات - يتم تقسيم الفجوة الإلكترونية بالتساوي. تطبيق: Cl 2 ، O 2 ، H 2 ، N 2 ، I 2.
إذا كانت الذرات التي تشكل رابطة تساهمية لها قيم مختلفة للسلبية الكهربية ، فإن الرابطة بينها تسمى قطبية تساهمية. في مثل هذه الجزيئات ، "القطب" - يتم تحويل الفجوة الإلكترونية إلى عنصر كهرسلبي أكبر. تطبيق: HCl ، HBr ، HI ، NH 3 ، H 2 O.

يمكن إنشاء رابط تساهمي وراء آلية التبادل - قابلية استخدام الرهان الإلكتروني. في مثل هذه الطريقة من السلخ ، تضع الذرة "مع ذلك" رابطًا في الرابط. على سبيل المثال ، ذرتا نيتروجين ، التي تشكل جزيء N 2 ، تعطي 3 إلكترونات لكل مستوى خارجي لتكوين الرابطة.
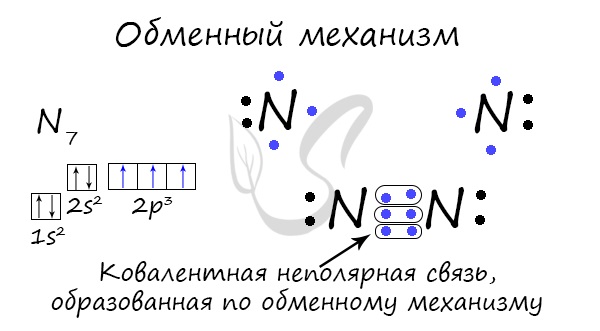
يستخدم آلية متبرع متقبل لإنشاء رابطة تساهمية ، عندما تعمل ذرة واحدة كمانح لرهان إلكتروني غير مشترك. لا تلطخ الذرة الثانية إلكتروناتها ، ولكنها تلطخ أقل بقليل من المدار (الوسط) للرهان الإلكتروني.
- NH 4 + - في أيون الأمونيوم
- NH 4 + Cl ، NH 4 + Br - في منتصف أيون الأمونيوم في أملاح اليوغا الجافة
- NO 3 - - في أيون النترات
- KNO 3 ، LiNO 3 - في منتصف أيون النترات في جميع النترات
- يا 3 - الأوزون
- H 3 O + - أيون الهيدروكسونيوم
- ثاني أكسيد الكربون - ثاني أكسيد الكربون
- K ، Na 2 - في جميع الأملاح المعقدة ، هناك حاجة إلى رابطة تساهمية واحدة ، وهي فينيل وفقًا لآلية متلقي المانح

آونا zv'azok
الرابطة الأيونية هي أحد أنواع الروابط الكيميائية ، والتي تعتمد على التفاعل الكهروستاتيكي بين الأيونات المشحونة البروتيلية.
في الحالة الأكثر شيوعًا ، يتم إنشاء رابطة أيونية بين معدن نموذجي وغير معدني نموذجي. يتقدم:
NaF ، CaCl 2 ، MgF 2 ، Li 2 S ، BaO ، RbI.
نصيحة رائعة هي العمل كجدول للتباين ، حتى لو كانت جميع الأملاح يمكن أن تصنع رابطًا أيونيًا: CaSO 4 ، Na 3 PO 4. لإنشاء أيون أمونيوم لا يستحق اللوم ، بين كاتيون الأمونيوم والأنيونات المختلفة ، أيون أيوني تم إنشاء الارتباط ، على سبيل المثال ، في z'єd Nanny: NH 4 I، NH 4 NO 3، (NH 4) 2 SO 4.
غالبًا في الكيمياء ، توجد مجموعات من الروابط في منتصف جزيء واحد. دعونا نلقي نظرة ، على سبيل المثال ، فوسفات الأمونيوم ، للكشف عن نوع الرباط الجلدي في منتصف الجزيء.

الرابطة المعدنية هي نوع من الروابط الكيميائية التي تتفاقم مرة واحدة بسبب الذرات والمعادن. هذا النوع من الترابط من vio-kremlin ، مثل تركيز yogo vіdminnіstyu є vysokoї في معادن الموصلية الإلكترونية - "الغاز الإلكتروني". بطبيعتها ، الرابطة المعدنية قريبة من التساهمية.
"الخمارة" للإلكترونات الموجودة في معادن المبنى لا تدخل الهواء تحت تسريب جديد. هو نفسه سبب التوصيل الكهربائي للمعادن.

الرابط المائي هو نوع من الارتباط الكيميائي الذي يستقر بين جزيئات مختلفة للانتقام من الماء. من أكثر أنواع العفو شيوعًا أن نتذكر أنه في حالة روابط الغاز والماء والماء ، قد تكون - الأمر ليس كذلك.
تتشكل روابط الماء بين ذرة الماء والذرة الكهربية الأصغر (O ، S ، N ، C).
من الضروري ملاحظة أهم التفاصيل: يتم إنشاء روابط مائية بين الجزيئات وليس في المنتصف. الرائحة الكريهة بين الجزيئات:
- H2O
- الكحولات العضوية: Z 2 H 5 OH، C 3 H 7 OH
- الأحماض العضوية: CH 3 COOH ، C 2 H 5 COOH

في كثير من الأحيان ، بالنسبة إلى الوصلات المائية ، يميل المرء إلى أن يكون نفس الكرمة ، بسبب تقوية القوى الحمضية في سلسلة الأحماض المائية: HF → HCl → HBr → HI. الفلور هو عنصر EO-im ، يجذب بقوة ذرة من الماء وجزيء آخر ، مما يقلل من الحموضة ويقسم الماء ويقلل من قوته.
© بيلفيتش يوري سيرجيوفيتش 2018-2020
كتب هذا المقال يوري سيرجيوفيتش بيلفيتش وسلطته الفكرية. النسخ والتوسيع (بما في ذلك طريقة النسخ على المواقع والموارد الأخرى على الإنترنت) أو ما إذا كان من الأفضل استخدام المعلومات والأشياء دون إذن مسبق من السلطة القانونية لإعادة المحاكمة وفقًا للقانون. لأخذ مواد المقال ، سأسمح لهم بالفوز ، والتحول ، والطيبة ، حتى
