А чи не з ін. Фосфат-аніонами. У розчинах фосфорної має місце обмін між групами PO 4 і.
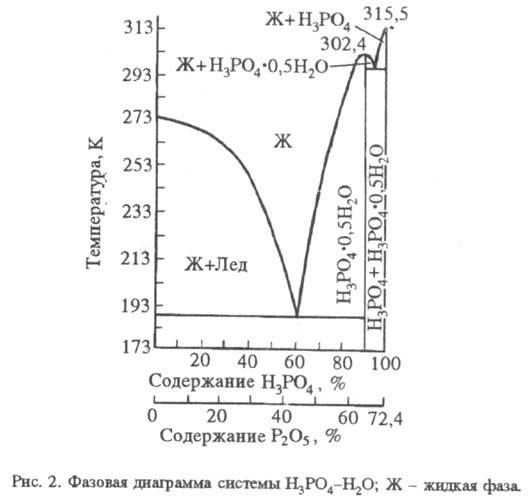
H 3 PO 4 - сильна к-та, K 1 7,1 · 10 -3 (рК а 2,12), K 2 6,2 · 10 -8 (рК а 7,20), K 3 5,0 10 -13 (рК а 12,32); значення K 1 і K 2 залежать від т-ри. по першій ступені екзотермічну, по другій і третій - ендотермічна. системи H 3 PO 4 - H 2 O приведена на рис. 2. Максимум кривої - при т-ре 302,4 К і змісті H 3 PO 4 91,6% (тверда фаза - гемігідрат). У табл. наведені св-ва розчинів фосфорної.
ХАРАКТЕРИСТИКА ВОДНИХ H 3 PO 4
|
T. затв., 0 C |
T. кип., 0 C |
кДж / (кг · К) |
Па · с (25 0 C) |
Уд. елект. провідність, См / м (25 0 C) |
|||||
|
H 3 PO 4 |
P 2 O 5 |
||||||||
|
5 |
3,62 |
0,8 |
100,10 |
4,0737 |
0,0010 |
10,0 |
3129,1 |
||
|
10 |
7,24 |
2,10 |
100,20 |
3,9314 |
0,0011 |
18,5 |
3087,7 |
||
|
20 |
14,49 |
6,00 |
100,80 |
3,6467 |
0,0016 |
18,3 |
2986,4 |
||
|
30 |
21,73 |
11,80 |
101,80 |
3,3411 |
0,0023 |
14,3 |
2835,7 |
||
|
40 |
28,96 |
21,90 |
103,90 |
3,0271 |
0,0035 |
11,0 |
2553,1 |
||
|
50 |
36,22 |
41,90 |
104,00 |
2,7465 |
0,0051 |
8,0 |
2223,8 |
||
|
60 |
43,47 |
76,9 |
114,90 |
2,4995 |
0,0092 |
7,2 |
1737,1 |
||
|
70 |
50,72 |
43,00 |
127,10 |
2,3278 |
0,0154 |
6,3 |
1122,6 |
||
|
75 |
54,32 |
17,55 |
135,00 |
2,2692 |
0,0200 |
5,8 |
805,2 |
||
Ф осфорная при нормальних умовах малоактивна і реагує лише з, і недо-римі. При цьому утворюються одно-, дво- і тризаміщені (див.). При нагр. вище 80 0 C реагує навіть з неактивними, і. при підвищених т-рах фосфорна кислота слабкий для. При дії на металеві. пов-сть р-ром фосфорної з Zn або Mn утворюється (фосфатування). Фосфорна при нагр. втрачає з утворенням послідовно піро-і метафосфорной к-т:
Фосфолеум (рідкий, суперфосфорної к-та) включає до-ти, що містять від 72,4 до 88,6% P 2 O 5, і являє собою рівноважну систему, що складається з орто-, піро-, Тріполі-, тетраполі- і ін . фосфорних к-т (див.). При розведенні суперфосфорної к-ти виділяється значить. кол-во тепла, і поліфосфорниє к-ти швидко переходять в ортофосфорну.
Від ін. Фосфорних к-т H 3 PO 4 можна відрізнити по р-ції з AgNO 3 - випадає жовтий осад Ag 3 PO 4. Решта фосфорні к-ти утворюють білі опади.
Отримання.Фосфорну в лаб. умовах легко отримати 32% -ним розчином азотної к-ти:
У промисловості фосфорну отримують термічним і екстракційним способами.
Тримаючи. спосіб (дозволяє виробляти наиб. чисту фосфорну) включає осн. стадії: спалювання () елементного в надлишку, і отриманого P 4 O 10 (см.), фосфорної і уловлювання туману з газової фази. Існують два способи отримання P 4 O 10: P (в пром-сти використовують рідко) і рідкого P у вигляді крапель або плівки. P в пром. умовах визначається т-рій в зоні, компонентів і ін. чинниками. Другу стадію отримання тримаючи. фосфорної кислоти-P 4 O 10 - здійснюють к-тій () або взаємо-мод. P 4 O 10 с. (P 4 O 10 + 6H 2 O 4H 3 PO 4) протікає через стадії освіти поліфосфорних к-т. Склад і виникають продуктів залежать від т-ри і парціального.
Всі стадії процесу м. Б. суміщені в одному апараті, крім уловлювання туману, до-рої завжди виробляють в окремому апараті. У промисловості зазвичай використовують схеми з двох або трьох осн. апаратів. Залежно від принципу охолодження існують три способи вироб-ва тримаючи. фосфорної: випарний, циркуляционно-випарний, теплообмін-но-випарний. Випарує. системи, засновані на відводі теплоти при або разб. фосфорної, наиб. прості в аппаратурном оформленні. Однак через відносно великого обсягу відходять використання таких систем доцільно лише в установках невеликої одиничної потужності.
Циркуляційної-випарує. системи дозволяють поєднати в одному апараті стадії спалювання P, охолодження газової фази циркулюючої к-тій і P 4 O 10. Недолік схеми - необхідність охолодження великих обсягів к-ти. Теплообмінне-випарує. системи поєднують два способи відведення теплоти: через стінку веж спалювання і охолодження, а також шляхом з газової фази; суттєву перевагу системи - відсутність контурів циркуляції к-ти з насосно-холодильним обладнанням.
На батьківщин. підприємствах експлуатують технол. схеми з циркуляційної-випарує. способом охолодження (двухбашен-ва система). Відрізнить. особливості схеми: наявність додатніт. вежі для охолодження, використання в циркуляційних контурах ефективних пластинчастих; застосування високопроизводит. форсунки для спалювання P, що забезпечує однорідне тонкодисперсное розпорошення струменя рідкого P і повне його згорання без освіти нижчих.
Технол. схема установки потужністю 60 тис. т в рік 100% -ної H 3 PO 4 приведена на рис. 3. Розплавлений жовтий розпорошується нагрітим під до 700 кПа через форсунку в башті спалювання, зрошуваною циркулюючої к-тій. Нагріта в башті к-та охолоджується зворотному в пластинчастих. Продукционная к-та, що містить 73-75% H 3 PO 4, відводиться з контуру циркуляції на склад. Доповнить, охолодження з вежі спалювання і до-ти виробляють в башті охолодження (), що знижує послід, температурне навантаження на електрофільтр і сприяє ефективній. Відведення теплоти в башті здійснюється циркулюючої 50% -ної H 3 PO 4, охолоджувальної в пластинчастих. з вежі після очищення від туману H 3 PO 4 в пластинчастому електрофільтрі викидаються в. На 1 т 100% -ної H 3 PO 4 витрачається 320 кг P.
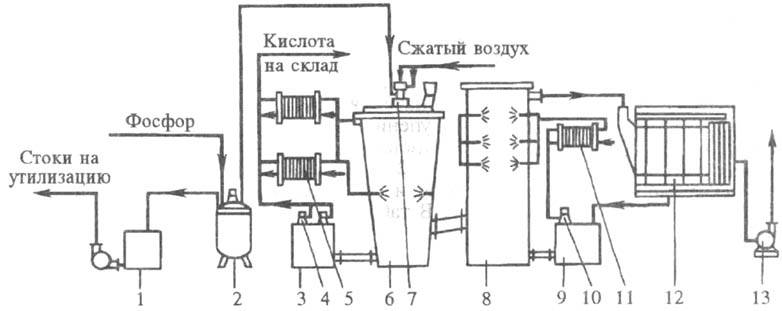
Мал. 3. Циркуляційна двухбашенного схема произова тримаючи. H 3 PO 4: 1 - збірник кислому; 2 - сховище; 3,9 - циркуляційні збірники; 4,10 - по-гружние; 5,11 - пластинчасті; 6 - вежа спалювання; 7 - фосфорна форсунка; 8 -вежі; 12 - електрофільтр; 13 - вентилятор.
Більш економічний екстракційний метод отримання фосфорної заснований на розкладанні прир. к-тами (в осн. сірчаної, в меншій мірі азотної і незначно соляної). Фосфорнокислиє розчини, отримані розкладанням азотної к-тій, переробляють в комплексні, розкладанням соляної к-тій - в.
Сірчанокислотне розкладання фосфатного сировини [в країнах СНД гл. обр. Хибинского апатитового концентрату (див.) і Каратау] - осн. метод отримання екстракційної фосфорної, застосовуваної для вироб-ва конц. фосфорних і комплексних. Суть методу - витяг () P 4 O 10 (зазвичай використовують ф-лу P 2 O 5) у вигляді H 3 PO 4. За цим методом прир. обробляють H 2 SO 4 з послід, отриманої пульпи для відділення фосфорної від осаду Ca. Частина виділеного осн. фільтрату, а також весь фільтрат, отриманий при на, повертають в процес (р-р розведення) для забезпечення достатньої рухливості пульпи при її та транспортуванні. Масове співвідношення між рідкою і твердою фазами від 1,7: 1 до 3,0: 1.
Прир. розкладаються за схемою:
До розкладання к-тами піддаються також супутні домішки:, сидерит, глауконіт, і ін.. Це призводить до збільшення витрати використовуваної к-ти, а також знижує вилучення P 2 O 5 в цільовий продукт внаслідок утворення нерозчинних FeH 3 (PO 4) 2 · 2,5H 2 O при P 2 O 5 вище 40% (вміст P 4 O 10 зазвичай дається в перерахунку на P 2 O 5) і FePO 4 · 2H 2 O - при більш низьких. виділяющійся при розкладанні СО 2 утворює в стійку; р-рімие Mg, Fe і Al знижують фосфорної, а також зменшують вміст засвоюваних форм P 2 O 5 в при послід. переробці фосфорної.
З урахуванням впливу домішок визначені вимоги до фосфатного сировини, згідно к-рим прир. з підвищеним вмістом сполуки. Fe, Al, Mg, і орг. в-в непридатні для вироб-ва фосфорної.
Залежно від т-ри і фосфорної в системі CaSO 4 -H 3 PO 4 -H 2 O Ca осідає у вигляді дигідрату (), гемігідрату або ангідриту. В реальних умовах осад забруднений домішками P 2 O 5 у вигляді неразложенном прир. , Недоотмитой H 3 PO 4, сокрісталлізованних разл. та ін., тому що утворюються Ca зв. соотв. фосфогіпс, фосфогемігідрат і фосфо-ангідрит. Залежно від типу осаждаемого розрізняють три прямих способу вироби, екстракційної фосфорної: дігідратний, полугідратний (гемігідратний) і ангідрит-ний, а також комбіновані: полугідратно-дігідратний і дігідратно-полугідратний.
У СНД наиб. відпрацьований в пром-сті дігідратний спосіб, к-рий відрізняється високим виходом P 2 O 5 (93-96,5%) в продукционную к-ту; проте щодо низкая фосфорної вимагає її послід. упарювання. Осн. стадії процесу: з зовн. або внутр. циркуляцією і вакуумним або повітряним охолодженням екстракційної пульпи, дозрівання пульпи після, відділення фосфорної на наливних. Ефективність процесу визначають в осн. P 2 O 5 і пульпи. Апаратурнеоформлення має забезпечити повноту розкладання сировини і Ca в умовах мінім. пересичення їм рідкої фази. Оптим. форма і розміри
Нерідко метал і вироби з нього піддаються характерною «хвороби», яка проявляється у вигляді рудого нальоту, що роз'їдає метал. Йдеться про іржі. Її утворення відбувається завдяки впливу на поверхню металевого виробу вуглекислого газу, кисню і води. Безумовно, для того щоб продовжити термін служби виробу з металу необхідно якомога швидше почати боротьбу з корозією. Допомогти в цьому може обробка ортофосфорної кислотою.
Почувши слово кислота, людина мимоволі напружується, адже ще з давніх уроків хімії в шкільні роки відомо, що кислота може надавати досить значущий вплив на предмети або, наприклад, шкіру людини. А що собою являє ортофосфорна кислота? Чи небезпечна ортофосфорна кислота, застосування якої рекомендується як один із способів боротьби з нальотом іржі?
Ортофосфорна або просто фосфорна кислота представляється у вигляді продукту, що має неорганічне походження. В умовах нормальної кімнатної температури ортофосфорна кислота має вид невеликих ромбовидних кристалів.
Найчастіше ж ортофосфорна кислота має вид утворення сиропу 85% відсоткова розчину, що не має характерного запаху. Кристалики ортофосфорної кислоти досить добре розчиняються у воді або етанолі.
Рівняння ортофосфорної кислоти
Застосовується ортофосфорна кислота в наступних галузях людської діяльності:
- Створення добрив (фосфатних),
- Виробництво спеціальних засобів для чищення, що відносяться до класу побутової хімії,
- Стоматологія,
- Речовини для боротьби з корозією металу,
- засоби захисту рослин,
- Харчова промисловість.
Якщо температура навколишнього середовища, наприклад, в умовах лабораторних досліджень перевищує показники в 213 градусів Цельсія, ортофосфорна кислота перетворюється в пірофосфорна кислоту. Склад ортофосфорної кислоти і її хімічна формула, відповідно, змінюється.
Таблиця 1. Фізико-хімічні показники ортофосфорної кислоти згідно ГОСТ 10678-76.
| найменування показника | норма | ||
|---|---|---|---|
| Марка А | Марка Б | ||
| 1-й сорт | 2-й сорт | ||
| 1. Зовнішній вигляд | Безбарвна рідина прозора в шарі 15-20 мм при розгляді на білому фоні | Безбарвна або зі слабо-жовтим відтінком рідина в шарі 15-20 мм при розгляді на білому фоні | Безбарвна або пофарбована рідина з відтінком від слабо-жовтого до коричневого, що не прозора в шарі 15-20 мм при розгляді на білому фоні |
| 2. Масова частка ортофосфорної кислоти (H3PO4),%, не менше | 73 | 73 | 73 |
| 3. Масова частка хлоридів,%, не більше | 0,005 | 0,01 | 0,02 |
| 4. Масова частка сульфатів,%, не більше | 0,010 | 0,015 | 0,020 |
| 5. Масова частка нітратів,%, не більше | 0,0003 | 0,0005 | 0,0010 |
| 6. Масова частка заліза,%, не більше | 0,005 | 0,010 | 0,015 |
| 7. Масова частка важких металів сірководневої групи,%, не більше | 0,0005 | 0,002 | 0,005 |
| 8. Масова частка миш'яку,%, не більше | 0,0001 | 0,006 | 0,008 |
| 9. Масова частка відновлюють речовин,%, не більше | 0,1 | 0,2 | Не нормується |
| 10. Наявність метафосфорной кислоти | витримує випробування | ||
| 11. Масова частка зважених часток,%, не більше | витримує випробування | 0,3 | |
| 12. Наявність жовтого фосфору | витримує випробування | Не нормується | |
Таблиця 2. Фізико-хімічні показники ортофосфорної кислоти згідно ГОСТ 6552-80.
| найменування показника | норма | ||
|---|---|---|---|
| Хімічно чистий (х.ч.) ОКП 26 1213 0023 08 | Чистий для аналізу (ч.д.а.) ОКП 26 1213 0022 09 | Чистий (ч.) ОКП 26 1213 0021 10 | |
|
1. Зовнішній вигляд і колір |
Прозора безбарвна рідина не містить зважених часток | ||
|
2. Масова частка ортофосфорної кислоти (H 3 PO 4),%, не менше |
87 | 85 | 85 |
|
3. Щільність Р4 20, г / см 3, не менше |
1,71 | 1,69 | 1,69 |
|
4. Масова частка залишку після прожарювання,%, не більше |
0,05 | 0,1 | 0,2 |
|
5. Масова частка летючих кислот (СН 3 СООН),%, не більше |
0,0004 | 0,0010 | 0,0015 |
|
6. Масова частка нітратів (NO 3),%, не більше |
0,0003 | 0,0005 | 0,0005 |
|
7. Масова частка сульфатів (SO 4),%, не більше |
0.0005 | 0.002 | 0.003 |
|
8. Масова частка хлоридів, (Cl)%, не більше |
0.0001 | 0.0002 | 0.0003 |
|
9. Масова частка амонійних солей (NН 4),%, не більше |
0,0005 | 0,002 | 0,002 |
|
10. Масова частка заліза (Fe),%, не більше |
0,0005 | 0,001 | 0,002 |
|
11. Масова частка миш'яку (As),%, не більше |
0.00005 | 0.0001 | 0.0002 |
|
12. Масова частка важких металів (Pb),%, не більше |
0,0005 | 0,0005 | 0,001 |
|
13. Масова частка речовин, що відновлюють KMnO 4 (H 3 PO 3),%, не більше |
0.003 | 0.005 | 0.05 |
 Сучасна наука досить часто дозволяє використовувати один і той же хімічна речовина або один і той же хімічний склад в абсолютно різних цілях. Те ж саме можна сказати і про варіанти застосування ортофосфорної кислоти.
Сучасна наука досить часто дозволяє використовувати один і той же хімічна речовина або один і той же хімічний склад в абсолютно різних цілях. Те ж саме можна сказати і про варіанти застосування ортофосфорної кислоти.
На сьогоднішній день, існує чимала кількість різноманітних сфер застосування ортофосфорної кислоти. Так, наприклад, дану кислоту можуть застосовувати при органічному синтезі. Застосовують її у випадках, коли потрібно створити фосфорні солі натрію, кальцію, алюмінію, марганцю.
Велике значення і використання ортофосфорної кислоти в промисловості по металообробки, оскільки тут практично незамінна ортофосфорна кислота, вплив якої доведено при видаленні іржі або запобігання її появи.
Ортофосфорну кислоту можна виявити і в складі великої кількості речовин, призначених для використання господинями в побуті. Відомо і про її використанні в медичній і харчовій промисловості.
Серед інших сфер, де можна виявити застосування ортофосфорної кислоти, можна назвати:
- Нафтову промисловість,
- Виготовлення сірників,
- Виготовлення кіноплівки,
- Виробництво протипожежних або вогнетривких предметів і матеріалів.
Велика роль ортофосфорної кислоти і в процесі підживлення рослин, оскільки широко відомо, благотворний вплив фосфору на здатність рослин давати високі врожаї. Сільськогосподарські культури завдяки цій кислоті набувають стійкості до заморозків і інших несприятливих умов.
Сприятливий вплив на грунт також відзначається в багатьох джерелах, що відносяться до предмету землеробства або народного господарства.
Значення ортофосфорної кислоти важливо і для тварин. Вона не тільки спільно з іншими органічними речовинами бере участь в метаболічних процесах тваринного організму, але ще і допомагає в освіті у деяких видів тварин панцирів і інших природних наростів, оскільки в їх складі є фосфат кальцію.
Застосовується ортофосфорна кислота і у вигляді харчової добавки в деяких продуктах харчування. Вона має код Е 338. Своє призначення в харчовій промисловості дана кислота знаходить у виробництві ковбас, деяких видів плавлених сирів, газованих напоїв.
Слід зазначити, що не варто зловживати продуктами харчування, в складі яких зазначено присутність ортофосфорної кислоти, оскільки не з'ясовано яка норма споживання її людиною в добу. Але в будь-якому випадку користь від її споживання незрівнянно мала, якщо навіть не сказати, незначна, в порівнянні з тією шкодою, яку вона може завдати у вигляді порушення роботи шлунково-кишкового тракту, виникнення карієсу, розвитку остеопорозу.
 Як і будь-яка інша кислота, ортофосфорна вимагає від людини граничної уважності, акуратності і виконання всіх правил безпеки при роботі з кислотами.
Як і будь-яка інша кислота, ортофосфорна вимагає від людини граничної уважності, акуратності і виконання всіх правил безпеки при роботі з кислотами.
Ортофосфорна кислота є досить агресивною хімічною речовиною при неправильному її використанні та нехтування технікою безпеки застосування ортофосфорної з'єднання може спричинити виникнення опіків на шкірних покривах. Пари фосфорної кислоти, можуть спровокувати опіки слизової дихальних шляхів, а також прояв ознак серйозної інтоксикації організму людини. Крім цього, ортофосфорна кислота є пожежо- та вибухонебезпечним з'єднанням. Саме тому дуже важливо дотримуватися визначені правила при роботі з фосфорною кислотою.
- Працювати з кислотою потрібно тільки в умовах добре провітрюється.
- При роботі з кислотою, слід особливу увагу приділити захисній екіпіровці у вигляді рукавичок, маски або краще респіратора і очок для захисту очей.
- Не допускати попадання кислоти на відкриті ділянки тіла, інакше можуть виникнути сильні опіки.
- Якщо кислота, все ж, потрапила на шкіру, її слід якомога швидше змити великою кількістю проточної води і обов'язково звернутися в лікарню.
Транспортування і зберігання ортофосфорної кислоти також вимагає обов'язкового дотримання певних умов.
Зберігати кислоту можна тільки в скляних ємностях, а також в полімерних судинах і судинах з нержавіючої сталі.
Перевозити реагент дозволяється тільки спеціальними автотранспортними засобами, які оснащені металевими цистернами, які не піддаються впливу кислоти. Транспортування допускається також і іншими видами транспорту, наприклад, поїздами або водними судами, але за умови повного дотримання вимог техніки безпеки.
Умови зберігання кислоти передбачають її приміщення в таке місце, куди не проникає сонячне світло. Зберігати в таких умовах ортофосфорна з'єднання можна не більше одного року.
 Ортофосфорна кислота, вплив якої на іржу широко відомо, може застосовуватися як в промислових масштабах, так і для видалення корозії металу в домашніх умовах. Зрозуміло, що подібні дії повинні проводитися з урахуванням описаних вище правил безпеки.
Ортофосфорна кислота, вплив якої на іржу широко відомо, може застосовуватися як в промислових масштабах, так і для видалення корозії металу в домашніх умовах. Зрозуміло, що подібні дії повинні проводитися з урахуванням описаних вище правил безпеки.
Явною перевагою саме фосфорної кислоти є те, що за умов хімічної очистки з поверхні металу за допомогою фосфорної кислоти можна не тільки прибрати пухкі окислилися маси, але і створити тим самим невелику захисну плівку на поверхні металевого виробу. Утворення такої плівки відбувається наступним чином: оксид заліза роз'їдається і поглинається кислотою, натомість відбувається фосфарірованіе поверхні металу. Люди, проробляти подібну процедуру очищення, свідчать про те, що після зняття іржі за допомогою застосування кислоти ортофосфорної на поверхні металевого виробу утворюється масляниста плівка сірого відтінку.
На даному етапі можна назвати кілька основних способів боротьби з утворенням оксидів на металевих поверхнях:
- Травлення металу, що передбачає повне його занурення в розчин кислоти,
- Розпилення з'єднання за допомогою пульверизатора або нанесення її допомогою валика,
- Механічне очищення металу від оксидів з наступним застосуванням кислоти.
Найбільш відповідний і ефективний метод очищення металу від корозії підбирається в кожному конкретному випадку з урахуванням індивідуальних умов, в яких можливе проведення процедури.
 З огляду на, що існує кілька варіантів очищення металу із застосуванням ортофосфорна з'єднання, слід розглянути кожен з них докладніше.
З огляду на, що існує кілька варіантів очищення металу із застосуванням ортофосфорна з'єднання, слід розглянути кожен з них докладніше.
Очищення з повним зануренням очищається деталі, наприклад, вимагає попереднього очищення деталі від жирів будь-якого походження. Для цього достатньо промити металевий виріб за допомогою будь-якого миючого засобу. Далі потрібно розчинити в одному літрі води 150 мл кислоти. Після того, як розчин буде готовий потрібно опустити в нього деталь на одну годину. При цьому потрібно постійно розмішувати розчин, щоб кислота краще діяла.
Після того, як кислота зробила свою дію, і іржа розчинилася, необхідно змити ортофосфорну кислоту за допомогою спеціального розчину, склад якого є 50 частин води, 2 частини нашатирного спирту, 48 частин спирту.
Закінченням процедури стане ополіскування деталі проточною водою і сушка.
Якщо металевий виріб через його великих розмірів можна занурити в контейнер, то тут можна застосувати інший спосіб видалення іржі. Для цього потрібно нанести ортофосфорну кислоту за допомогою розпилювача, валика або звичайної кисті на поверхню металу. У деяких випадках, можливо, буде потрібно попередня ручна очистка іржі. Після того, як частина іржі буквально віддерти з поверхні металевого виробу, на метал наноситься розчин кислоти, витримується певний час, після чого виріб омивається нейтрализующим кислоти розчином і проводиться його сушка.
В обох випадках при необхідності можна збільшувати період дії кислоти на оксиди металу.
Можливе застосування ортофосфорної кислоти і при необхідності очищення домашніх унітазів, ванн і раковин. Але слід запам'ятати, що не варто застосовувати ортофосфорну кислоту, як і інші види кислот для очищення акрилових сантехнічних елементів.
Фаянсові й емальовані поверхні можна очистити таким способом. Попередньо знежирену будь-яким миючим засобом поверхню обробляють кислотним розчином. Для його приготування потрібно взяти і переміщати 1 літр води з 200 гр фосфорної кислоти. Залежно від ступеня забруднення кислоту потрібно залишити на поверхні на 1-12 годин. Після закінчення часу кислоту потрібно нейтралізувати розчином соди і змити.
матеріали по темі
Протягом трьох кварталів нинішнього року на модернізацію технологічних процесів і оснащення ПАТ «Пігмент» (Тамбов) витратив більше 366 млн рублів. Проекти з нарощування потужності реалізуються в виробництвах акрилових емульсій та сульфаминовой кислоти. У цехах з виробництва пігментів, відбілювачів і полуфабрикатних лаків проводяться роботи по поліпшенню якісних характеристик матеріалів, застосовуються нові технології.
В ході реалізації планів з імпортозаміщення на виробничих майданчиках заводу «Курганхіммаш» вперше в нашій державі випущена партія офшорних танк-контейнерів. Тара виготовляється з нержавіючої сталі товщиною 6 мм, внутрішня поверхня яких покрита особливим матеріалом для захисту від дії агресивних середовищ. Дані ємності дозволяють зберігати і транспортувати соляну кислоту під тиском не вище 0,4 МПа при температурах навколишнього середовища від -40 до +500 ° С.
Застосування ЛФМ обумовлено різними вимогами. Але найбільш поширені - це для декоративного оздоблення і для захисту різних матеріалів від несприятливих впливів для збереження їх довговічності.
Загальні відомості про фосфорної кислоти.
1. Історія відкриття та отримання фосфорної кислоти.
Фосфорну кислоту відкрив Р. Бойль за допомогою індикаторів. Спалюючи фосфор і розчиняючи утворився білий продукт у воді він отримав невідому хімікам кислоту. За вихідним речовини він назвав її фосфорної.
Технічно фосфорну кислоту вперше отримали понад 100 років тому розкладанням низькоякісних фосфоритів, що містять значні кількості сполук тривалентних металів, розведеної (5-10%) сірчаної кислотою, в якій з'єднання заліза і особливо алюмінію переходять в розчин в незначній мірі.
Розчин з концентрацією 8-10% Р 2 О 5 упаривали до змісту в ньому приблизно 40% Р 2 О 5. При розкладанні фосфатної породи більш концентрованою (30-40%) сірчаної кислотою виділяються голчасті кристали гіпсу. Вони утримують значну кількість рідкої фази і погано промиваються. Внаслідок цього втрати Р 2 О 5 великі.
Істотним кроком вперед у виробництві фосфорної кислоти був перехід до установок безперервної дії і розведення 75 і 93% -ної сірчаної кислоти не водою або слабкими промивальним водами, а розчином фосфорної кислоти, тобто проведення процесу із застосуванням розчину розведення. У цих умовах виділяються ромбічні кристали, які добре фільтруються і відмиваються.
2. Фізичні властивості.
Ортофосфорна кислота в чистому вигляді при звичайних умовах являє безбарвні кристали ромбічної форми, що плавляться при температурі 42.3 о С. Однак з такою кислотою хіміки зустрічаються рідко. Набагато частіше вони мають справу з напівгідрат Н 3 РО 4 * 0.5 Н 2 О, який випадає у вигляді безбарвних гексагональних призм при охолодженні концентрованих водних розчинів ортофосфорної кислоти. Температура плавлення полугидрата 29.3 о С.
Чистий Н 3 РО 4 після плавлення утворює в'язку маслообразную рідина з малої електричну провідність і сильно зниженою здатністю до дифузії. Ці властивості, а також детальне вивчення спектрів показують, молекули Н 3 РО 4 в даному випадку практично не диссоційовані і об'єднані міцними водневими зв'язками в єдину макромолекулярную структуру. Як правило, молекули пов'язані один з одним однієї, рідше двома і дуже рідко трьома водневими зв'язками.
Якщо ж кислоту розбавляти водою, то її молекули охочіше утворюють водневі зв'язки з водою, ніж один з одним. Через таких "симпатій" до води кислота змішується з нею в будь-яких відносинах. Енергія гідратації тут не така велика, як у сірчаної кислоти, тому розігрівання Н 3 РО 4 при розведенні не настільки сильне і дисоціація виражена менше. За першого ступеня дисоціації ортофосфорна кислота вважається електролітом середньої сили (25 - 30%), по другий - слабким, по третій - дуже слабким.
3. Будова
Наближене уявлення про будову молекули Н 3 РО 4 дає її структурна формула. Але тут потрібні уточнення
просторове
АЛЕ - Р - ОН будова
структурна
Просторове розташування атомів і довжини зв'язків в молекулі призводять до висновку, що зв'язок Р = О насправді не подвійна, тобто її кратність не дорівнює 2. Відповідно до розрахунків кратність зв'язку з цим 1,74. Зв'язок Р - О (Н) теж не одинарна. Якщо її кратність дорівнювала 1, то довжина була б 0,17 нм. Насправді в ортофосфорної кислоти і большенстве її кислих солей довжина зв'язку з цим 0,154 - 0,157 нм, що відповідає кратності 1,3 - 1,4. Отже, електронна щільність подвійний зв'язку Р = О частково "розтікається" за трьома іншим зв'язкам, злегка збільшуючи їх кратність. Крім того, між атомами кисню і фосфором виникає помітне донорно-акцепторна взаємодія. Все це разом узяте призводить до того, що в Н 3 РО 4 немає такого різкого відмінності в довжинах зв'язків, яке спостерігається у сірчаної та азотної кислот. Довжини зв'язків Р = О і Р - О (Н) виявляються майже вирівняними, і остов молекули перетворюється фактично в тетраедр. Зрозуміло, така перебудова різко підвищує стійкість самої кислоти і її похідних. Звідси випливає своєрідна хімічна пасивність ортофосфорної кислоти.
4. Хімічні властивості Н 3 РО 4
Ортофосфорна кислота у водних розчинах набагато слабкіше сірчаної та азотної кислот. Це триосновна кислота. Електролітична дисоціація кислоти, як і інших многоосновних кислот, здійснюється східчасто:
Н 3 РО 4 Н + + Н 2 РО 4 - (I ступінь)
Н 2 РО 4 - Н + + НРО 4 2- (II ступінь)
НРО 4 2- Н + + РО 4 3- (IIIступень)
Н 3 РО 4 3Н + + РО 4 3- (Сумарне ураненіе)
Порівняємо значення констант іонізації кислоти відповідних ступенів:
[Н +] [Н 2 РО 4 -]
До 1 = = 7,52 10 -3
[Н +] [НРО 4 2-]
До 2 = = 6,31 10 -8
[Н +] [РО 4 3-]
До 3 = = 1,2 10 -12
Як показують ці дані, в розчині Н 3 РО 4 в основному присутні дігідрофосфот-іони Н 2 РО 4 -. Іонів, що утворюються по другого ступеня дисоціації, - гидрофосфат-іонів НРО 4 2-, значно менше. І майже відсутні фосфат-іони РО 4 3- - продукти третьої, останнього ступеня іонізації. За першого ступеня іонізації фосфорна кислота є кислотою середньої сили. Відповідно до існуванням трьох видів кислотних залишків при нейтралізації фосфорної кислоти лугами утворюються солі: дигідрофосфат, гідрофосфат, а також фосфати, наприклад:
Н 3 РО 4 + NaOH NaH 2 PO 4 + H 2 O
дигидрофосфат
H 3 PO 4 + 2NaOH Na 2 HPO 4 + 2H 2 O
гідрофосфат
H 3 PO 4 + 3NaOH Na 3 PO 4 + 3H 2 O
Ортофосфорну кислоту можна відрізнити від інших фосфорних кислот по реакції з нітратом срібла - утворюється жовтий осад
Н 3 РО 4 + 3AgNO 3 Ag 3 PO 4 + HNO 3
Всі інші фосфорні кислоти утворюють білі опади.
При упарюванні ортофосфорної кислоти утворюється дифосфорная (пірофосфорна) кислота:
2Н 3 РО 4 = Н 4 Р 2 О 7 + Н 2 О.
5. Значення фосфорної кислоти
Фосфорна кислота має велике значення як один з найважливіших компонентів живлення рослин. Фосфор використовується рослинами для побудови своїх самих життєво важливих частин - насіння і плодів.
Похідні ортофосфорної кислоти конче потрібні як рослинам, а й тваринам. Кістки, зуби, панцири, пазурі, голки, шпильки у большенства живих організмів складаються, в основному, з ортофосфата кальцію. Крім того, ортофосфорна кислота, створюючи різні з'єднання з органічними речовинами, активно беруть участь в процесах обміну речовин живого організму з навколишнім середовищем. В результаті цього похідні фосфору зберігають у кістках, мозку, крові, в м'язових і сполучних тканинах організмів людини і тварин. Особливо багато ортофосфорної кислоти в складі нервових (мозкових) клітин, що дозволило А.Є. Ферсману, відомому геохимику, назвати фосфор "елементом думки". Вельми негативно (захворювання тварин на рахіт, недокрів'я, і ін.) Позначається на стані організму зниження вмісту в раціоні харчування сполук фосфору або уведення в неусвояемой формі.
6. Застосування фосфорної кислоти (див. Таблицю № 1)
Застосовують ортофосфорну кислоту в даний час досить широко. Основним її споживачем служить виробництво фосфорних і комбінованих добрив. Для цих цілей щорічно видобувається в усьому світі фосфоросодержащей руди близько 100 млн. Т. Фосфорні добрива не тільки сприяють підвищенню врожайності різних сільськогосподарських культур, а й надають рослинам зимостійкість і стійкість до інших несприятливих кліматичних умов, створюють умови для більш швидкого дозрівання врожаю в районах з коротким вегетативним періодом. Вони також сприятливо діють на грунт, сприяючи її структуірованію, розвитку ґрунтових бактерій, зміни розчинності інших містяться в грунті речовин та придушенню деяких які виникають шкідливих органічних речовин.
Чимало ортофосфорної кислоти споживає харчова промисловість. Справа в тому, що на смак розбавлена ортофосфорна кислота дуже приємна і невеликі її добавки в мармелади, лимонадів і сиропи помітно покращують їх смакові якості. Цим же властивістю володіють і деякі солі фосфорної кислоти. Гідрофосфат кальцію, наприклад, з давніх давен входить у хлібопекарні порошки, поліпшуючи смак булочок і хліба.
Цікавими є й інші застосування ортофосфорної кислоти в промисловості. Наприклад, було помічено, що просочування деревини самої кислотою і її солями роблять дерево негорючим. На цій основі зараз виробляють вогнезахисні фарби, негорючі фосфодревесние плити, азбестовий фосфатне пінопласт і інші будівельні матеріали.
Різні солі фосфорної кислоти широко застосовують у багатьох галузях промисловості, в будівництві, різних галузях техніки, в комунальному господарстві і побуті, для захисту від радіації, для пом'якшення води, боротьби з котельної накипом і виготовлення різних миючих засобів.
Фосфорна кислота, конденсовані кислоти і дегідротірованние фосфати служать каталізаторами в процесах дегідратірованія, алкілування і полімеризації вуглеводнів.
Особливе місце займають фосфорорганічні сполуки як екстрагентів, пластифікатори, мастильні речовини, присадки до пороху та абсорбенти в холодильних установках. Солі кислих алкилфосфатов використовують як поверхнево-активні речовини, антифризи, спеціальні добрива, антикоагулянти латексу та інших. Кислі алкилфосфатов застосовують для екстракційної переробки урановорудних лугів.
Дане хімічна речовина є неорганічною сполукою. Воно також відоме під назвою «фосфорна кислота», однак цей термін можна віднести до всіх кислот, що містить фосфор.
Ортофосфорна кислота та її особливості
Як хімічний реагент речовина в основному використовується в розчиненому у воді вигляді. Подібні розчини можуть мати різні показники pH-рівня (в межах від 1,08 до 7,00), в залежності від кількості доданої кислоти. 85-відсотковий розчин даного хімічного елемента дає їдку рідину, однак при додаванні води кислотний рівень швидко знижується. Ортофосфорна кислота має хімічну формулу - H 3 PO 4. При стандартній кімнатній температурі речовина має кристалічну форму. При підвищенні температури понад 42,35 градусів кристали починають розтоплювати, утворюючи безбарвну рідина без запаху. Ортофосфорна кислота має полярну молекулярну структуру. Це говорить про те, що речовина дуже добре розчиняється у воді.
Ортофосфорна кислота та її застосування
 Найбільш активним чином дана речовина використовується в якості харчової добавки. У міжнародному стандарті ортофосфорна кислота - харчова - має ідентифікаційний номер E338. Вона використовується для додання їжі або напоїв кислуватого смаку. Особливо інтенсивно ортофосфорна кислота застосовується для створення безалкогольних Такі світові бренди, як Coca-Cola або Pepsi використовують дану харчову добавку для додання своєї продукції злегка кислуватого присмаку. По всьому світу налагоджено масове (і недороге, до того ж) виробництво даної речовини, тому воно є другим в списку найбільш затребуваних продуктів для виготовлення подібних напоїв. Лимонна кислота, Яка використовується для тих же цілей, зазвичай менш затребувана (можливо, тому, що ціна на неї трохи вище, ніж на даний продукт).
Найбільш активним чином дана речовина використовується в якості харчової добавки. У міжнародному стандарті ортофосфорна кислота - харчова - має ідентифікаційний номер E338. Вона використовується для додання їжі або напоїв кислуватого смаку. Особливо інтенсивно ортофосфорна кислота застосовується для створення безалкогольних Такі світові бренди, як Coca-Cola або Pepsi використовують дану харчову добавку для додання своєї продукції злегка кислуватого присмаку. По всьому світу налагоджено масове (і недороге, до того ж) виробництво даної речовини, тому воно є другим в списку найбільш затребуваних продуктів для виготовлення подібних напоїв. Лимонна кислота, Яка використовується для тих же цілей, зазвичай менш затребувана (можливо, тому, що ціна на неї трохи вище, ніж на даний продукт).
Ортофосфорна кислота та її вплив на організм
Були проведені (і до цих пір проводяться) дослідження, спрямовані на виявлення впливу даного хімічного елемента на організм людини. Результати такі:

- Кілька наукових досліджень в області впливу на тіло людини хімічних речовин говорять про те, що дана кислота стає винуватцем зменшення щільності кісткової тканини.
- Одна з наукових робіт, яка проводилася з 1996 до 2001 року і була опублікована в американському журналі клінічного харчування (англ. The American Journal of Clinical Nutrition), явно показала зменшення щільності кісток у жінок, які щодня споживали колу.
- Ще одне дослідження, що фінансується концерном Pepsi, навпаки, показало, що нестача фосфору (а, отже, і будь-яких похідних від нього речовин) призводять до зниження згаданого розлади.
- Подальші вивчення дозволили зробити висновок, згідно з яким зменшення щільності кісток сприяє кофеїн, а зовсім не ортофосфорна кислота.
- У 2001 році також була опублікована наукова робота, в якій йдеться про те, що даний стан кісток, скоріше, викликається браком в харчуванні молока і молочних продуктів, ніж вживанням ортофосфорної кислоти або навіть кофеїну.
- Різні наукові роботи стверджують, що виникнення безлічі і утворення в них каміння сприяє саме ортофосфорна кислота. Шкода від напоїв, подібних колі, вивчається до цих пір, проте ніяких точних даних досі виявлено не було.
До найбільш хворобливого стану металевих деталей відноситься їх окислення і відкладення іржавого шару. Цей процес відбувається під впливом води, вуглекислого газу, а також кисню. В результаті такої хімічної реакції відбувається пошкодження металів і їх подальше руйнування. Для очищення поверхні і захисту від корозії використовується механічна обробка, а також хімічний вплив за допомогою кислотних засобів.
Що таке ортофосфорна кислота?
Це кристалічне з'єднання неорганічного типу представляє водний розчин (85%) утворення сиропу виду. Концентрована рідина має безбарвну консистенцію з повною відсутністю запаху. Завдяки такому стану вона відмінно покриває будь-яку поверхню.
Використовується даний продукт в харчовій галузі, стоматології, автомобільної, авіаційної промисловості, а також у виробах побутової хімії. Цей склад допомагає захистити металоконструкції від корозії, а на його основі створюються засоби від іржі. Численні грунтовки для металевих поверхонь для фарбування містять саме цей інгредієнт.
Найбільшою популярністю в автомобілістів користується ортофосфорна кислота, застосування від іржі якої дуже ефективно. Вона допомагає захистити від шкідливої дії як кузов авто, так і інші металеві елементи. З її допомогою металева поверхня очищується від оксидів і численних проявів корозії. Правильно оброблена таким фосфорним складом деталь отримує надійний, а також міцний захисний шар, що перешкоджає подальшого руйнування матеріалу. Видалення іржі за допомогою ортофосфорної кислоти є ефективним прийомом захисту металевих виробів
Технологія розведення ортофосфорної кислоти
Даний хімічний продукт має первісну кристалічну структуру. Він продається у вигляді звичайного порошку, якщо ще не знаходиться в розбавленому стані. Для отримання рідини використовується співвідношення складу до звичайної води в пропорції орієнтовно 1/5, 1/6. В результаті такого правильного розведення виходить 85% розчин прозорої консистенції.
Він застосовується в якості стандартного перетворювача іржі. Цей продукт є найпростішим, одержуваних в домашніх умовах. Ортофосфорна кислота від іржі є основою розчинів численних виробників, які містять додаткові добавки. Їх склад ретельно приховується для підтримки конкурентоспроможності товару. Готова до застосування ортофосфорна кислота проти впливу іржі може продаватися і в невеликих ємностях, проте її ціна при цьому істотно дорожче порошкової маси.
Для обробки металевих поверхонь використовується і рідина з розведеною кислотної концентрацією (15 - 30%). Після її нанесення відбувається реакція з іржею, яка перетворюється в дуже стійке захисне покриття. При цьому утворюється відкладення ортофосфата заліза, що створює плівку коричневого відтінку на поверхні виробу. Перед тим як розбавити ортофосфорну кислоту для видалення іржі необхідно виконати запобіжні заходи для роботи з небезпечною речовиною.
Захисні заходи при роботі
Даний розчин відноситься до небезпечних для здоров'я речовин, тому поводитися з ним треба дуже обережно. Перед використанням фосфорної рідини готується респіратор, а також захисні гумові рукавички. Вони захистять тіло від опіків, а дихальні шляхи - від впливу небезпечних парів. Крім цього, даний склад є вибухо- і пожежонебезпечних. Приміщення для виконання робіт повинно бути добре вентильованим.
При попаданні на шкірний покрив хімічного складу необхідно виконати обов'язкові дії:
- позбутися від одягу з потрапили на неї розчином;
- постраждалу ділянку шкірного покриву промити проточною водою протягом 15 хвилин;
- не допускати втирання засобу в шкіру і видалення його серветками;
- при триваючому палінні продовжити водну обробку ще 15 хвилин;
- на постраждалу ділянку накласти марлеву пов'язку;
- прийняти знеболюючий препарат.
Обов'язково зверніться за допомогою до медичного закладу щоб уникнути посилювання травми.
Процедура обробки іржі за допомогою ортофосфорної кислотного розчину вимагає особливої обережності і уважності.

Як використовувати кислотний склад для видалення іржі
Перетворювач іржі ортофосфорна кислота відмінно видаляє з металевої поверхні наявні оксиди і утворює спеціальну плівку, що захищає деталь. Він також використовується перед проведенням оцинкування виробів. Рідина роз'їдає оксид заліза з наступним його поглинанням, після чого фосфатується матеріал. Розрізняють два методи видалення жита з деталей:
- погружной метод;
- поверхневе нанесення.
погружной метод
Використовується при наявності достатнього обсягу розчину і ємності, в яку можна помістити оброблювану деталь. На попередньому етапі проводиться очистка вузла і його знежирення. У ємність заливається розчин з розрахунку 1 л звичайної води і 100 - 150 г кислоти (85%). Оброблювана деталь повністю занурюється в рідину і залишається для хімічної обробки на одну годину. Протягом цього часу ортофосфорна склад періодично перемішується.
Очищений елемент дістається і ретельно промивається, після чого обробляється нейтралізує сумішшю. Вона розлучається з 2% спирту нашатирного, а також 48% бутилового спирту і 50% води. На заключній стадії виріб омивається чистою водою і просушується. Не допускається пропуск будь-якого з етапів, так як це призведе до порушення хімічного процесу.
Травлення вироби буде проходити нерівномірно, якщо не провести знежирення поверхні. У цьому випадку розчин не прибере забруднення органічного характеру, внаслідок чого буде потрібно додаткове очищення проблемних місць. Даний спосіб використовується для елементів з різним ступенем корозії. Час обробки занурювальним методом, а також витрата складу безпосередньо залежить від товщини шару окислів на виробі.
Нехтування сушінням деталі після закінчення фінішної промивання призведе до утворення на поверхні гідроксиду. Просушування можна виконувати конвекційним способом або ж будь-яким іншим методом.

поверхневе нанесення
Для виробів великих розмірів застосовується поверхневе нанесення розчину. Перетворювач іржі на основі ортофосфорної кислоти використовують при недостатній кількості складу для погружной обробки. Рідина наноситься на поверхню металу за допомогою пензлика, що має натуральний ворс, валика або ж розпилювача.
Наявність товстого шару окислів зажадає додаткової механічної обробки поверхні по його усуненню. Іржавий наліт видаляється за допомогою шліфувальні машини з пелюстковим кругом або ж металевою щіткою. При відсутності електроінструменту поверхневий шар знімається ручним способом. Після закінчення механічної обробки проводиться знежирення з подальшим нанесенням кислотного розчину. Не допускайте пропусків оброблюваних ділянок.
Після закінчення двох годин проводиться видалення складу нейтралізує сумішшю. Після цього виконується фінішна промивка, а також сушка вироби. Невеликий шар окислів необов'язково піддавати механічній обробці, при цьому можливе повторне використання розчину. Ортофосфорна кислота, що міститься в перетворювачі іржі, ефективно впливає на найскладніші ділянки виробів.
Для поліпшення впливу в хімічний розчин додається катапін, що є інгібітором. Він загальмовує хімічний процес, а також перешкоджає реакції з не оксиди металів. На 1 л води такої суміші потрібно 1 -2 г катапін.

Переваги застосування ортофосфорної складу
Використання цього хімічного компонента при обробці металовиробів активно застосовується в численних перетворювачах. Вони не тільки розчиняють наявні оксиди, але і створюють плівковий захисний покрив. Крім цього, плюсом даного розчину є повна безпека для металу. Ортофосфорна кислота прибирає оксиди і виконує перетворення металевої іржі в фосфати заліза.
Такий склад застосовується для очищення і промивання: металопрокатних виробів, в тому числі арматури, поверхонь труб, водопостачальних та опалювальних систем, чавунних предметів, свердловин і котлів. Крім цього, він використовується для обробки теплообмінників, нагрівачів, бойлерів, змійовиків, а також численних металевих елементів механізмів і автомобілів.
До найбільш затребуваним засобів відноситься Цинкар, який має додаткові інгредієнти: марганець і кислота + цинк. Вони збільшують міцність захисного шару на поверхні обробленої деталі. Ціна в роздріб цих препаратів невелика. Використовуючи самостійно підготовлений склад або ж придбаний в магазині перетворювач, виконуйте всі заходи безпеки при роботі з цими небезпечними речовинами, а також уважно вивчайте інструкцію з їх застосування. Для наочного розуміння проведеної операції з видалення жита перегляньте додатково відео з процедурою обробки виробів.
